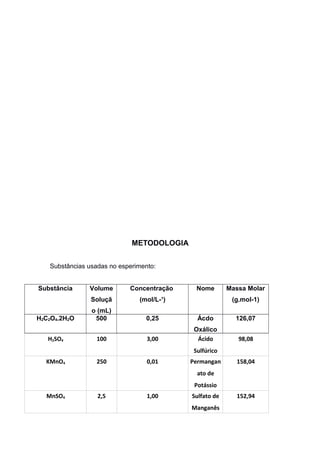
O documento relata um experimento sobre os fatores que influenciam a velocidade de uma reação química, realizado por estudantes de química. O experimento analisou o tempo de reação em diferentes situações, como diluição, uso de catalisador e temperatura, e concluiu que a concentração dos reagentes, presença de catalisador e aumento de temperatura reduzem o tempo de reação.

![INTRODUÇÃO
Segundo a teoria das colisões, para ocorrer reação química as partículas de
espécies reativas precisam colidir. Ao colidirem provocam rearranjos de átomos formando
novas ligações químicas.
Nesse sentido, as reações que envolvem rearranjo de muitos átomos tendem a ser
mais lentas, e consequentemente, as reações que envolvem poucos átomos tendem a ser
mais rápidas.
Para explicar como as reações acontecem, são propostos modelos de mecanismos
que justificam os fenômenos observados.
De acordo com um desses mecanismos, as reações não ocorrem em uma só
etapa. Antes da formação dos produtos, as colisões levam à formação de espécies
intermediárias. Obviamente, quanto maior for o número de espécies químicas envolvidas,
maior a necessidade de rearranjos e a quantidade de etapas envolvidas até a formação
dos produtos da reação.
A energia de ativação está diretamente associada com a rapidez da reação
química.
A etapa mais lenta é a que apresenta maior valor para a energia de ativação, e a
mais rápida, a que apresenta menor valor para a energia de ativação.
Uma forma de aumentar a rapidez de reações químicas é a utilização de
catalizadores: substâncias ou materiais que alteram a rapidez de reações, sendo
regenerados no final do processo, ou seja, não são consumidos.[1]](https://image.slidesharecdn.com/relatorio7-131109221216-phpapp02/85/Relatorio-2-320.jpg)







![envolvidas, maior sera o numero de colisões entre elas e consequentemente menor será
o tempo da reação.
REFERÊNCIAS BIBLIOGRÁFICAS
SANTOS, Wildson Luiz Pereira dos; MÓL, Gerson de Souza; MATSUNAGA, Roseli
Takako; DIB, Siland Meiry França; CASTRO, Eliane Nilvana F. de; SILVA, Gentil de Souza;
SANTOS, Sandra Maria de Oliveira; FARIAS, Salvia Barbosa. – Química & Sociedade.
São Paulo: Editora Nova Geração, 2005.[1]
PERUZZO, Tito Miragaia; CANTO, Eduardo Leite do; Química, Vol único, 1ª ed. – São
Paulo: Moderna, 1999.
KOTZ, Jonh C. ; TREICHEL, Paul M.; WEAVER, Gabriela C.; Química Geral e reações
químicas – São Paulo, 6ª edição americana: Cegage Learnig, 2010.](https://image.slidesharecdn.com/relatorio7-131109221216-phpapp02/85/Relatorio-11-320.jpg)
