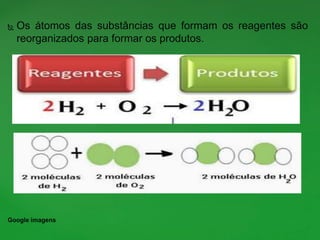
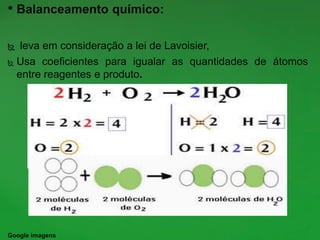
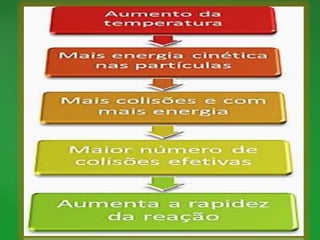
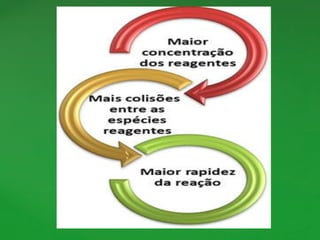
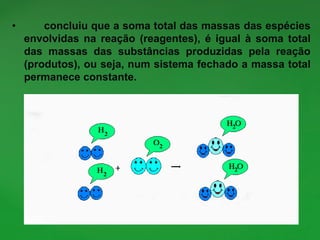
O documento discute conceitos fundamentais de reações químicas, incluindo o que é uma reação química, equações químicas, fatores que afetam a velocidade das reações e leis da química. É explicado que uma reação química envolve a reorganização dos átomos de substâncias para formar novos produtos e exemplos como combustão e ferrugem são dados.