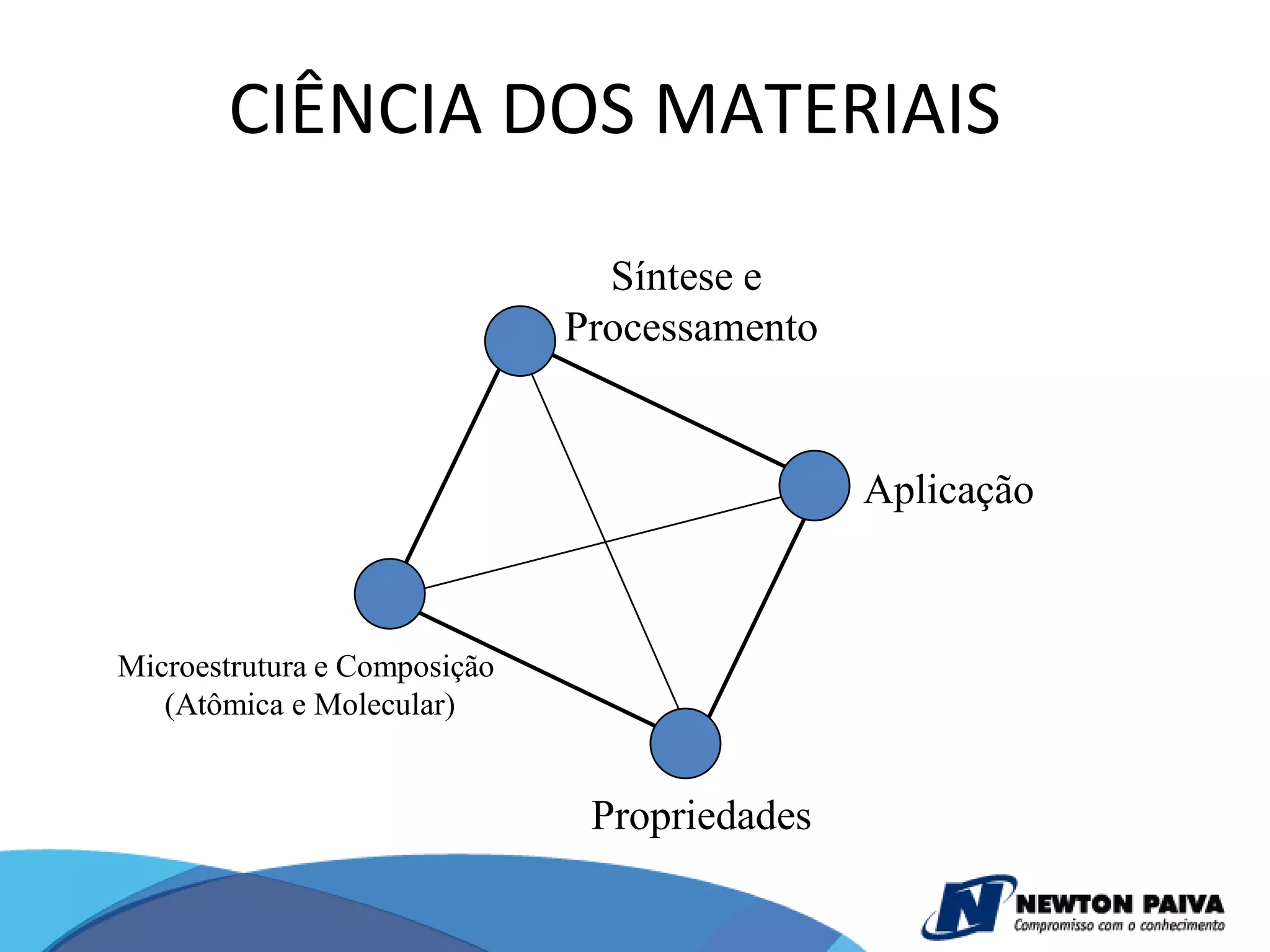
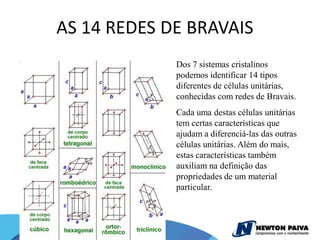
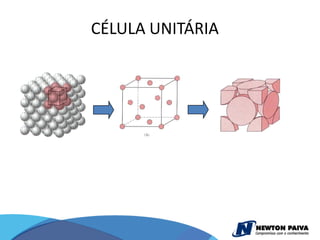
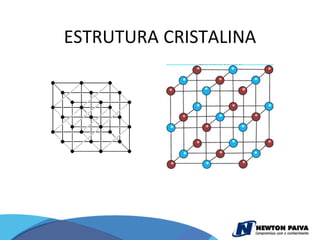
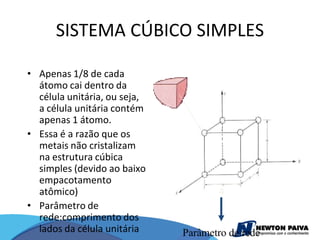
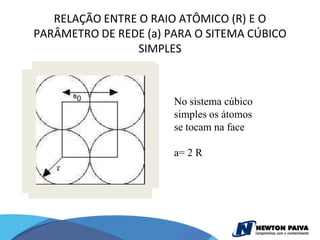
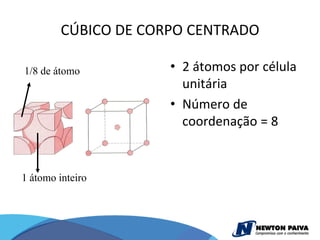
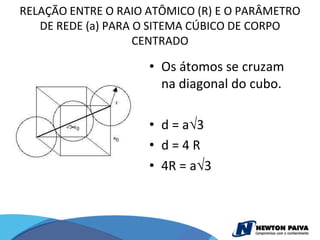
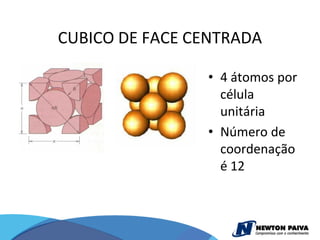
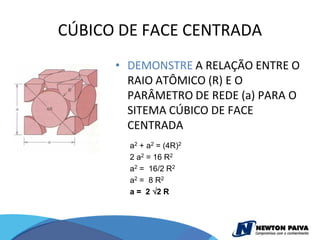
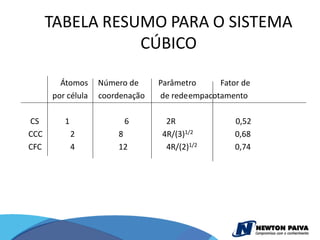
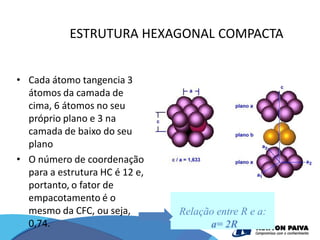
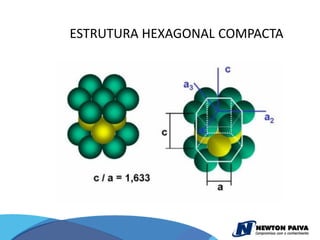
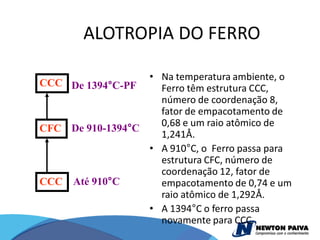
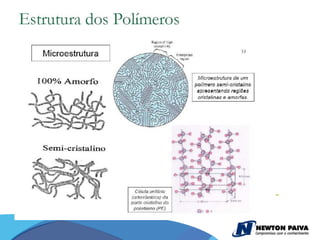
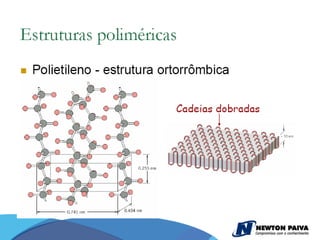
O documento discute estruturas cristalinas de materiais. Ele explica que os materiais podem ser cristalinos ou não-cristalinos dependendo da organização atômica. Materiais cristalinos possuem átomos organizados em uma estrutura tridimensional periódica chamada de rede cristalina, enquanto materiais não-cristalinos não possuem essa ordem de longo alcance. Ele também descreve estruturas cristalinas comuns como cúbica simples, cúbica de corpo centrado e cúb