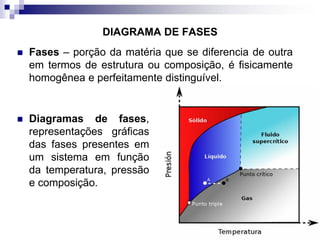
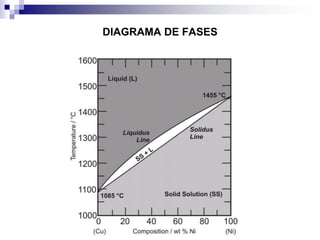
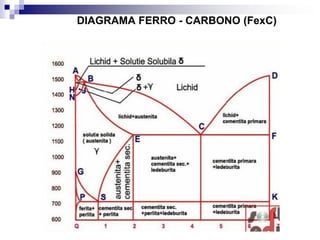
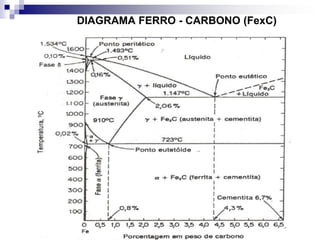
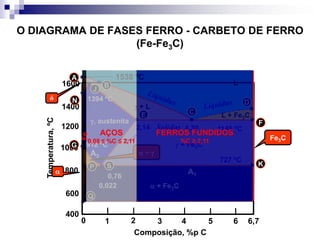
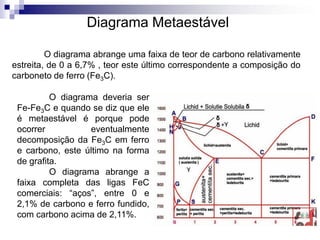
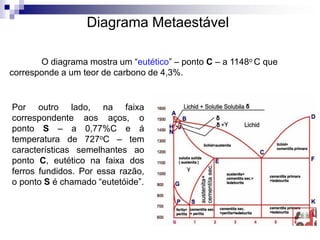
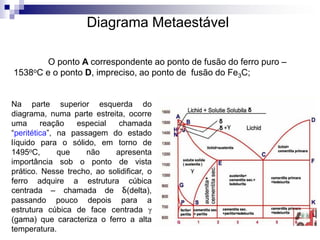
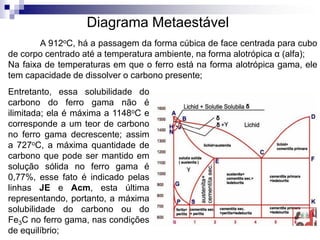
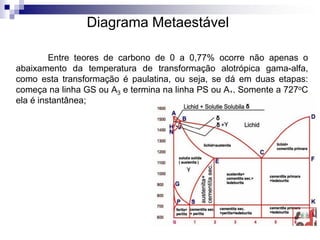
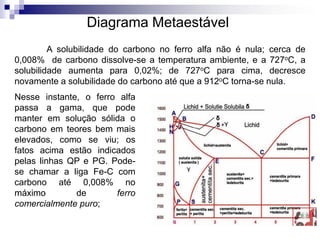
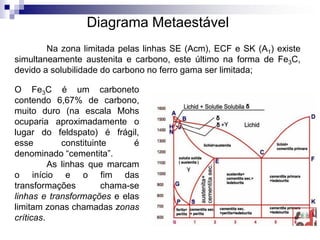
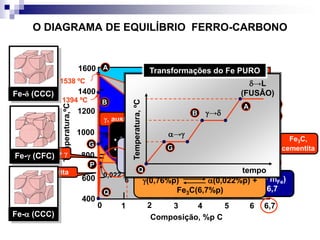
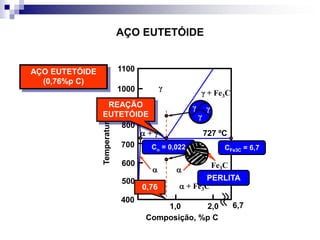
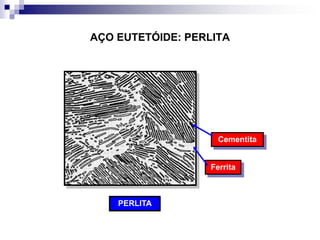
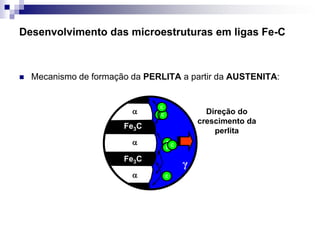
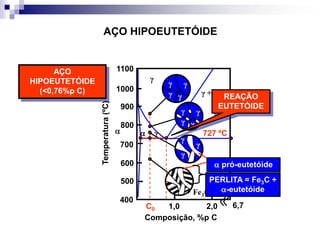
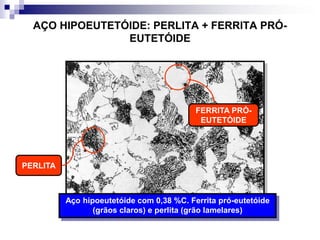
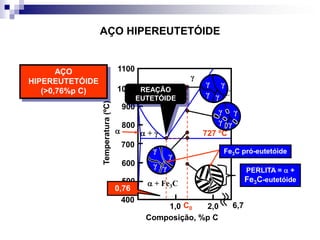
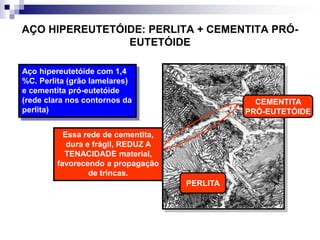
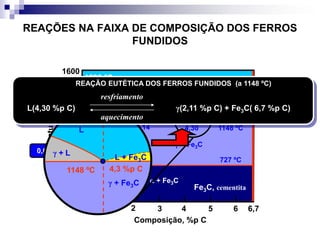
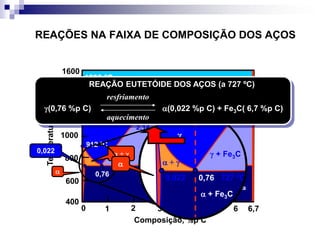
O documento descreve o diagrama de fases do sistema ferro-carbono, apresentando as principais fases sólidas e transformações que ocorrem com a variação da temperatura e composição de carbono, como a reação eutética a 1148°C e a reação eutetóide a 727°C.