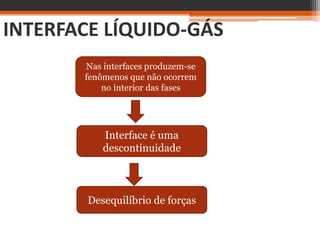
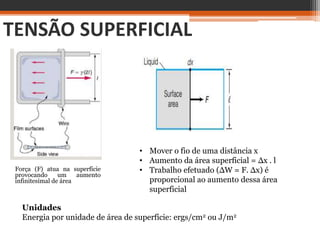
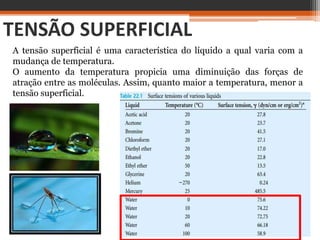
O documento discute conceitos básicos sobre interfaces entre fases da matéria, como sólido-líquido e líquido-gás. Explica que a interface é uma região de descontinuidade entre fases onde ocorrem fenômenos diferentes do interior das fases. A tensão superficial é definida como a energia necessária para se aumentar a área de superfície de uma interface líquido-gás, e é responsável pela forma esférica de gotas e pela capacidade de alguns insetos andarem sobre a água.