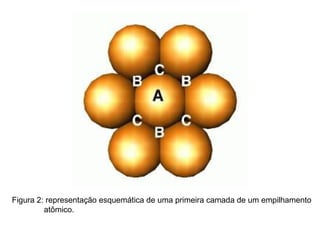
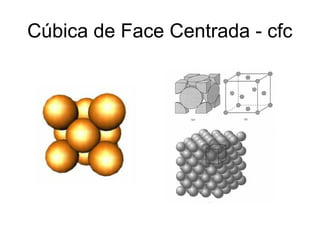
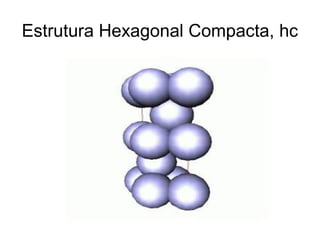
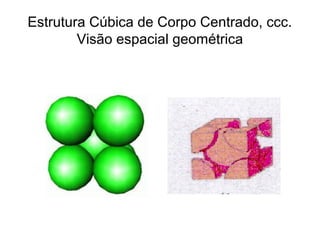
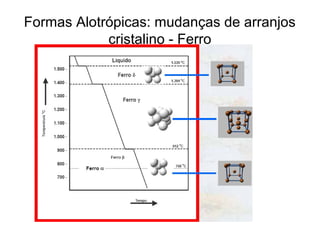
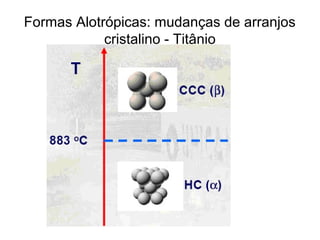
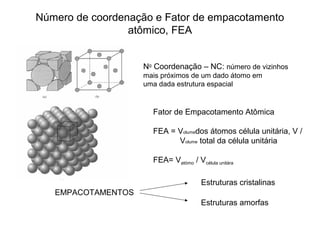
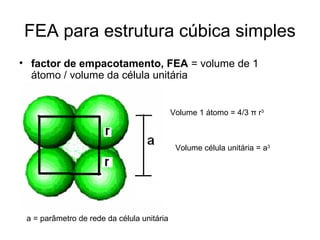
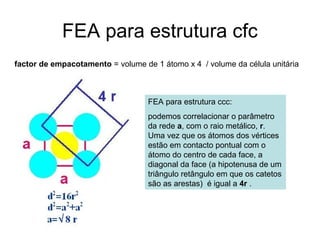
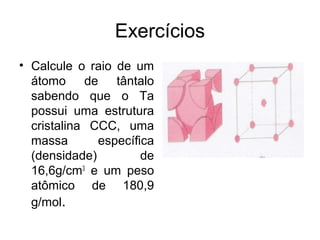
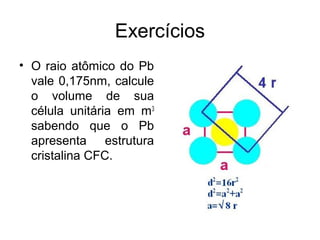
O documento discute as estruturas cristalinas dos metais. Apresenta os três tipos de ligações primárias - iônica, covalente e metálica - e como elas influenciam as propriedades dos sólidos. Também descreve as estruturas cúbicas de face centrada, de corpo centrado e hexagonal compacta, que são as estruturas mais comuns em metais.