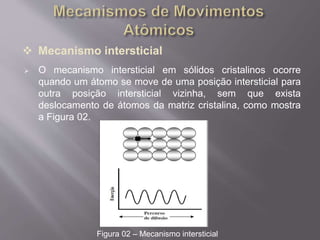
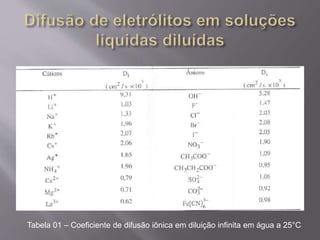
O documento discute os mecanismos de difusão atômica em sólidos, incluindo difusão por substituição, intersticial e em anel. A difusão depende de fatores como temperatura, estrutura cristalina, defeitos e energia de ativação. A difusão em sólidos porosos e de eletrólitos em soluções também é abordada.





















![ As velocidades dos íons são descritas
analogamente à teoria de Stokes-Einstein.
Em se tratando de eletrólitos, a velocidade do íon
está associada tanto com o potencial químico
quanto com o eletrostático.
(Velocidade) = (mobilidade)[diferença de potencial
químico) + (diferença de potencial eletrostático)]](https://image.slidesharecdn.com/difuso-140831135115-phpapp02/85/Difusao-23-320.jpg)

![Obtenção do coeficiente de difusão de eletrólitos em
soluções líquidas diluídas
Da tabela 01 temos que:
D1 = 퐷푁푎+ = 1,33x10−5 푐푚2/s
e D2 = 퐷퐶푙− = 2,03x10−5 푐푚2/s
퐷0퐴 =[
(⃓+1⃓ +⃓−1⃓)(1,33)(2,03)
(⃓+1⃓ 1,33 + ⃓−1⃓(2,03))
]x10−5 = 1,607 x 10−5 푐푚2/s](https://image.slidesharecdn.com/difuso-140831135115-phpapp02/85/Difusao-26-320.jpg)

