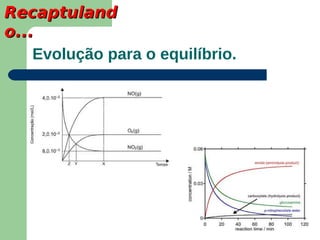
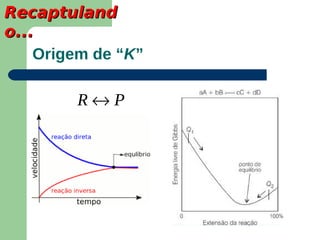
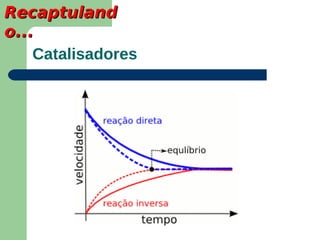
Este documento apresenta informações sobre equilíbrio químico, incluindo: 1) A definição de equilíbrio químico como o ponto em que a velocidade da reação direta é igual à velocidade da reação inversa; 2) Fatores que afetam o equilíbrio como temperatura, pressão e concentração de reagentes; 3) A constante de equilíbrio e suas propriedades.






![Recaptuland
o...
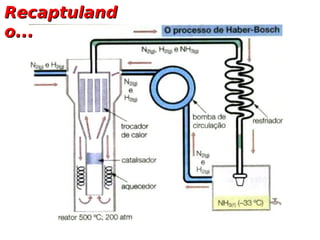
Constante de Equilíbrio
Exemplos: a) CaCO3( s ) ↔ CO( s ) + CO2 ( g )
K = PCO2
b) Ca ( OH ) 2 ( s ) ↔ Ca(2aq ) + 2OH (−aq )
+
[ ][
K = Ca 2+ OH − ] 2
+ +
c) Cu(2aq ) + Zn( s ) ↔ Cu( s ) + Zn(2aq )
K=
[ Zn ] 2+
[Cu ] 2+](https://image.slidesharecdn.com/aulaequilbrioquimico02-121023135234-phpapp01-121023141320-phpapp01/85/Aulaequilbrioquimico02-121023135234-phpapp01-8-320.jpg)





![Recaptuland
o...
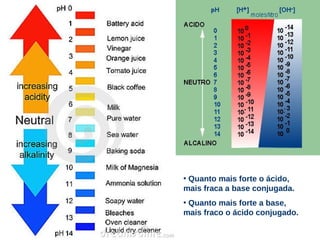
Auto ionização da água
Caráteranfótero.
Sorensen: escala de pH.
+ −
2 H 2O(l ) ↔ H 3O( aq ) + OH ( aq )
[ ])
pH = − log( H 3O +
pOH = − log( [OH ] ) −](https://image.slidesharecdn.com/aulaequilbrioquimico02-121023135234-phpapp01-121023141320-phpapp01/85/Aulaequilbrioquimico02-121023135234-phpapp01-18-320.jpg)
![Relações importantes
pH + pOH = 14 = pK w
[
K w = H 3O +
][OH ]; K
−
=
[ A ][ H O ] ;
−
3
+
Kb =
[ BH ][ HO ]
+ −
a
[ HA] [ B]
K a × Kb =
[ ][
A − H 3O + ] × [ BH ][ HO ] = K
+
−
[ HA] [ B] w
pK a + pK b = pK w](https://image.slidesharecdn.com/aulaequilbrioquimico02-121023135234-phpapp01-121023141320-phpapp01/85/Aulaequilbrioquimico02-121023135234-phpapp01-20-320.jpg)





![Como calcular o Ka de um ácido fraco?
Encontre o valor de Ka para uma solução de um ácido fraco de
concentração inicial de 0,010 M cujo pH em água é 2,95.
[ H O ] = 10 = 10
3
+ − pH −2 , 95
[H O ] = [ A ]
3
+ −
[ H O ] = 0,0011 mol.L
3
+ −1
[ HA] = [ HA] − [ H O ]
in 3
+
=
[ H O ][ A ] =
+ −
[ H O ] = 1,8 ×10
+ 2
−5
[ HA] − [ H O ]
3 3
Ka
[ HA] in 3
+
Ka =
( 0,0011) 2 = 1,4 ×10 − 4
0,010 − 0,0011](https://image.slidesharecdn.com/aulaequilbrioquimico02-121023135234-phpapp01-121023141320-phpapp01/85/Aulaequilbrioquimico02-121023135234-phpapp01-26-320.jpg)



