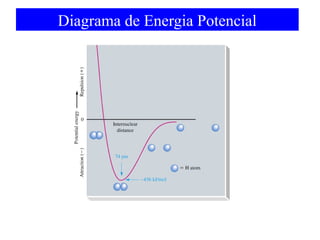
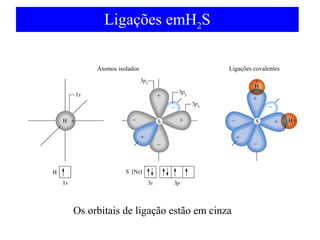
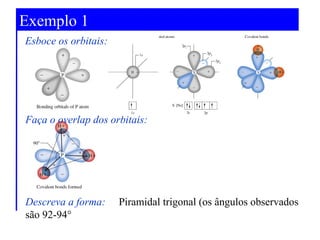
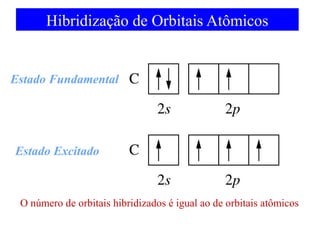
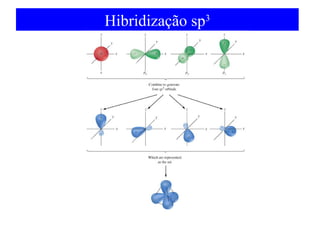
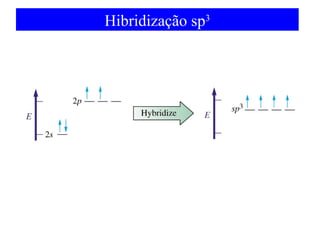
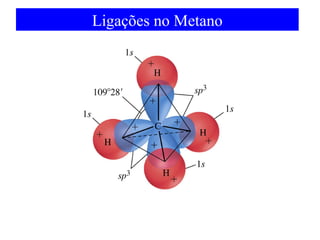
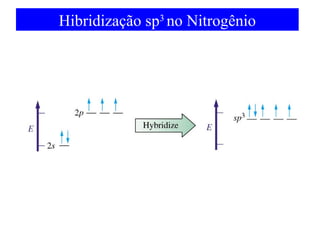
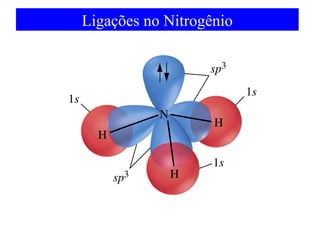
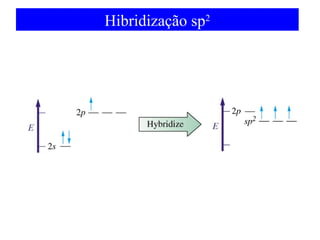
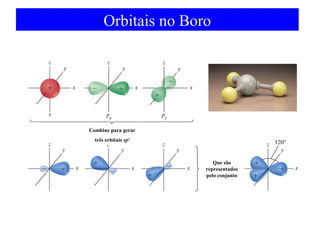
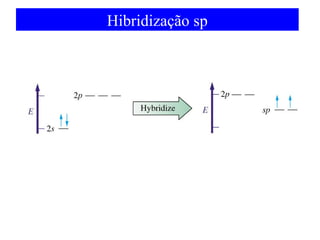
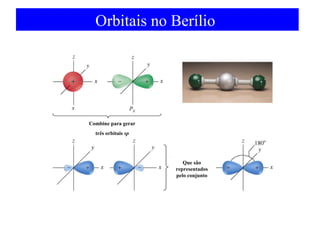
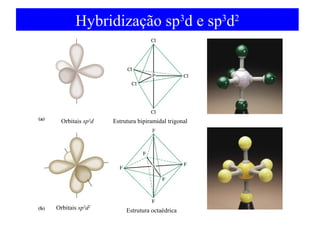
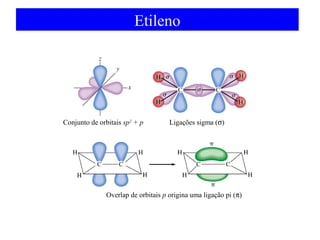
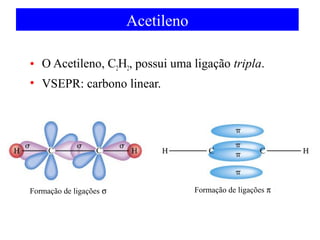
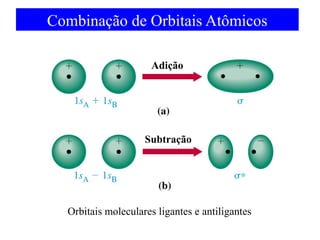
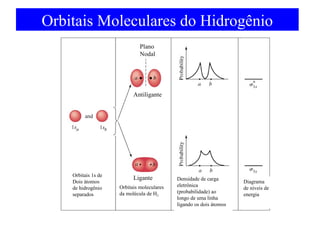
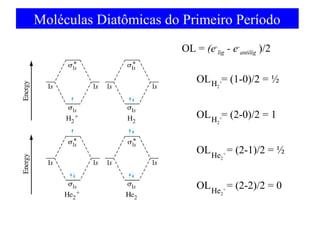
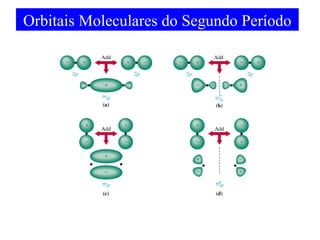
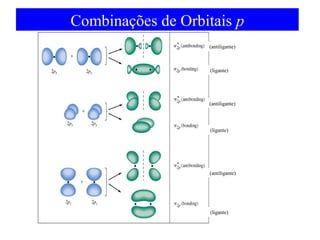
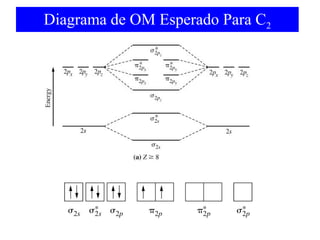
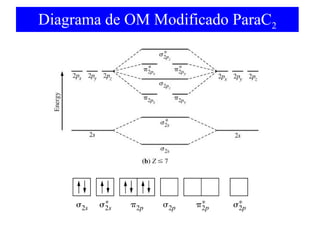
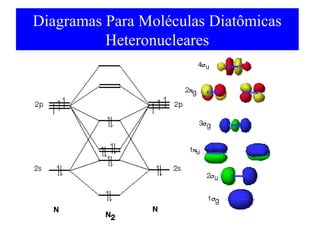
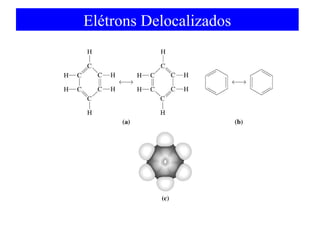
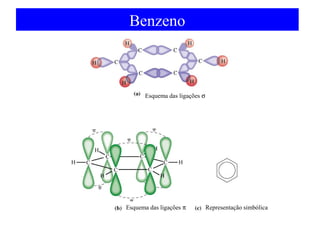
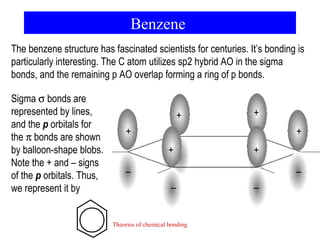
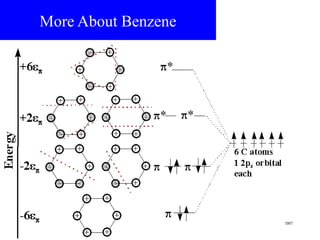
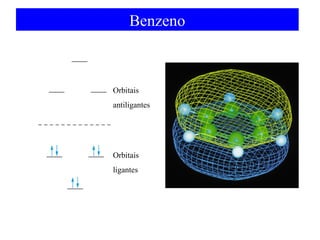
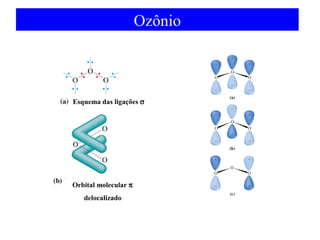
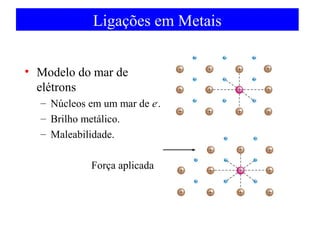
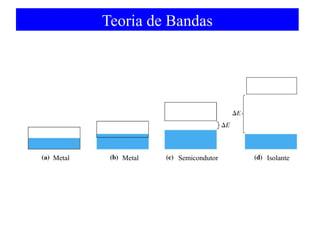
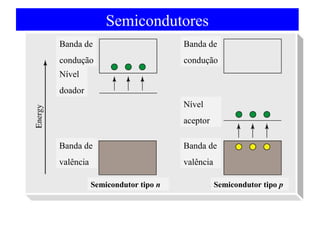
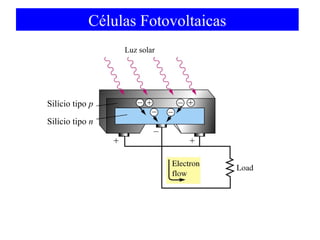
O documento discute as teorias de ligação química, incluindo: 1) A teoria da ligação de valência e sua limitação para explicar condutores e semicondutores; 2) A hibridização de orbitais atômicos para explicar geometrias moleculares; 3) A teoria dos orbitais moleculares para descrever ligações entre átomos.