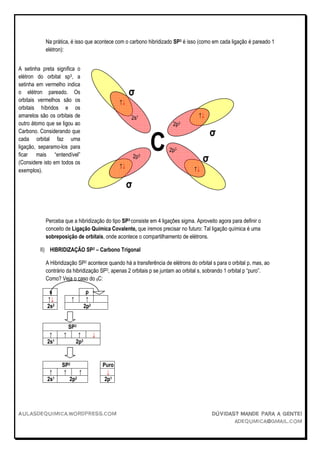
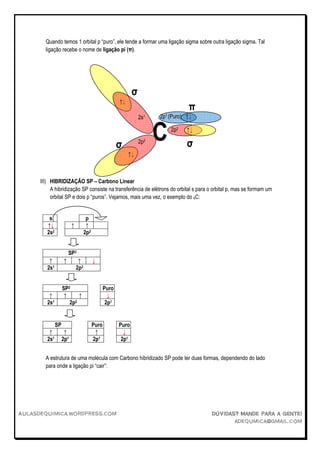
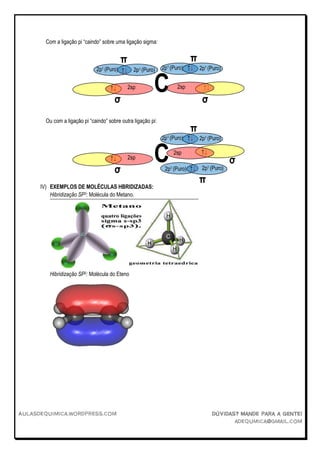
O documento discute os tipos de hibridização de orbitais SP3, SP2 e SP. A hibridização SP3 ocorre quando um orbital s transfere elétrons para três orbitais p, formando quatro orbitais híbridos sp3 e permitindo que o átomo forme quatro ligações. A hibridização SP2 envolve um orbital s e dois orbitais p, formando três orbitais híbridos sp2 e permitindo três ligações. A hibridização SP envolve um orbital s e um orbital p, formando dois orbitais híbridos sp e permitindo