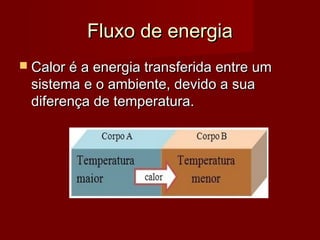
O documento discute conceitos termodinâmicos como calor, trabalho e a Primeira Lei da Termodinâmica. Explica que calor é energia transferida devido à diferença de temperatura entre um sistema e o ambiente, e que trabalho é outra forma de transferência de energia. Também define unidades de medição de calor como Joule e caloria, e conceitos como capacidade e calor específico que relacionam a quantidade de calor à variação de temperatura de um sistema.