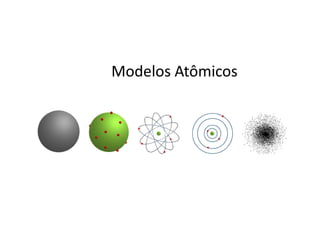
Modelos atômicos
- 1. Evolução dos Modelos Atômicos Marilena Meira
- 2. Modelo grego • Demócrito (460 a 370 a.C): “A matéria deve ser formada por partículas indivisíveis, os átomos”. (A = não ; tomo = parte). ÁTOMO = não + divisível
- 3. Tales de Mileto • O filósofo Tales de Mileto(640-546 a.C) fez algumas experiências com âmbar e descobriu que este material adquiri carga elétrica, quando é atritado com tecidos, como seda e lã. A palavra eletricidade é de origem grega, elektron, que significa âmbar(resina vegetal).
- 4. Benjamin Franklin Benjamin Franklin em 1852 observou que existem duas espécies de cargas elétricas, chamadas por ele de carga positiva e negativa. •Cargas de sinais opostos se atraem; •Cargas de mesmo sinal se repelem.
- 5. Modelo atômico de Dalton John Dalton (químico inglês) propôs o primeiro modelo atômico científico, em 1807. Propôs que qualquer espécie de John Dalton matéria é formada de átomos. (1766-1844) Para Dalton o átomo era rígido, indivisível, indestrutível e tinha uma forma esférica, semelhante a uma bola de bilhar.
- 6. As bases para o modelo de Dalton • Por volta de 1785, Antoine Laurent de Lavoisier demonstrou que não há variação da massa numa reação química: A massa dos produtos é igual à soma das massas das substâncias reagentes. • Em 1799, Joseph Louis Proust descobre a lei das proporções definidas, a qual afirma que: • Uma dada substância contém seus elementos constituintes na mesma proporção.
- 7. Teoria de Dalton • Qualquer espécie de matéria é formada por átomos. Os átomos são minúsculas partículas, que não podem ser subdivididas nem transformadas em outros átomos. • Todos os átomos de um mesmo elemento são iguais em massa, tamanho e em todas as suas propriedades, ou seja, possuem a mesma identidade química. • Átomos de elementos diferentes possuem propriedades químicas e físicas diferentes. • Um composto é constituído pela combinação de átomos de dois ou mais elementos que se unem entre si em várias proporções simples. Nessas combinações cada átomo guarda sua identidade química.
- 8. A descoberta do elétron O Experimento de Thomson: Em 1879, J. J. Thomson, verificou a existência dos elétrons através dos raios catódicos que são um feixe de partículas carregadas negativamente que sofriam atração do pólo positivo de um campo elétrico externo.
- 9. Descoberta do próton • Em 1886, o físico alemão Eugen Goldstein, observou feixe luminoso no sentido oposto aos dos elétrons, portanto, esses feixes deveriam ser carga elétrica positiva.
- 10. Modelo atômico de Thomson Em 1904, Thomson, propôs um novo modelo. Admitiu que o átomo era uma esfera maciça de carga Joseph Thomson positiva, estando os eletrons (1856-1940) dispersos no seu interior. (tal como as passas num pudim). Modelo do “ Pudim de passas”.
- 11. Modelo atômico de Rutherford Obtenção de partículas alfa
- 12. Modelo atômico de Rutherford Rutherford (1871-1937) 1.A grande maioria dos raios α passou pela lâmina. 2. Foram poucos os raios α refletidos pela lâmina. 3. Pouquíssimos raios α passaram pela lâmina sofrendo desvio.
- 13. Modelo atômico de Rutherford A maior parte do espaço do átomo é espaço vazio. No seu interior, existe uma pequena região central positiva (núcleo). No núcleo encontra-se a maior parte da massa do átomo. Os elétrons giram à volta do núcleo em órbitas circulares. Também conhecido como o modelo Planetário.
- 14. Descoberta do Nêutron • James Chadwick (1932) http://www.algosobre.com.br/quimica/descoberta-das-particulas-subatomicas.html
- 15. Propriedades das partículas sub- atômicas Partícula Massa (g) Carga Coulomb (C) Elétron 9,109383. 10-28 -1 -1,602176.10-19 Próton 1,672622. 10-24 +1 +1,602176.10-19 Nêutron 1,674927. 10-24 0 0
- 16. Falha do modelo de Rutherford • Bohr questionou o modelo de Rutherford: de acordo com a Física Clássica uma partícula negativa ao redor de outra positiva sofreria aceleração e perderia energia. • No caso do átomo o elétron adquiriria um movimento espiralado e acabaria por se chocar com o núcleo. • Mas, como não é o que acontece, Bohr estabeleceu seus postulados para explicar que o elétron no átomo pode possuir apenas certas quantidades restritas de energia.
- 17. Espectro descontínuo dos elementos químicos *Explicação do átomo baseado na luz emitida por alguns elementos quando aquecidos.
- 18. Postulados de Bohr • Em um átomo são permitidas ao elétron somente algumas órbitas circulares, sendo que em cada uma ele tem energia constante. • A energia do elétron é quantizada ou seja, um elétron não pode assumir qualquer valor de energia, mas somente determinados valores (órbitas permitidas), tendo assim determinados níveis de energia ou camadas energéticas. • Um elétron localizado numa dessas órbitas não perde nem ganha energia espontaneamente.
- 19. Postulados de Bohr • Um elétron pode receber energia de uma fonte externa somente em unidades discretas denominadas fótons. • Quando um elétron recebe um fóton de energia ele salta para uma órbita mais energética realizando um salto quântico e atingindo um estado excitado. • Quando o elétron retorna a sua órbita ele perde energia na forma de onda eletromagnética que corresponde à diferença de energia existente entre as órbitas envolvidas.
- 20. * O átomo é formado por um núcleo e níveis de energia quantizada ( onde estão os elétrons ), num total de sete.
- 21. Modelo atômico de Bohr Concebido, em 1913, por Bohr. (físico dinamarquês) O átomo possuí um núcleo central. Niels Bohr Os elétrons descrevem órbitas circulares em torno (1885-1962) do núcleo. Os elétrons só podem ocupar determinados níveis de energia. A cada órbita corresponde um valor de energia.
- 22. Modelo atômico de Sommerfeld • Sommerfeld verificou que as raias estudadas por Bohr eram na verdade um conjunto de raias finas. • Sommerfeld concluiu então que um dado nível de energia era constituído por subníveis de energia.
- 23. Evolução do modelo atômico LOUIS DE BROGLIE: demonstrou matematicamente o comportamento dualísta do elétron (partícula e onda). Equação de De Broglie: λ = h m.v h = 6,626. 10-34 J.s
- 24. Evolução do modelo atômico HEISEMBERG: demonstrou que é impossível determinar ao mesmo tempo a posição e a velocidade do elétron (PRINCÍPIO DA INCERTEZA). OBS: desta forma os elétrons passam a ocupar regiões, onde é máxima a probabilidade de estarem (ORBITAIS) Representação simbólica da nuvem eletrônica
- 25. Modelo atômico atual O átomo possui um núcleo central de reduzidas dimensões e uma nuvem eletrônica. No núcleo encontram-se os prótons e os nêutrons. Os elétrons encontram-se à volta do núcleo, na nuvem eletrônica. Regiões de máxima probabilidade de encontrar um elétron são denominadas de orbitais.
- 26. Conceitos fundamentais • Núcleo muito pequeno, contendo prótons e nêutrons; • Elétrons em torno do núcleo em orbitais. • Elétrons carregados negativamente; • Prótons carregados positivamente; • Nêutrons são neutros: • Prótons e nêutrons possuem aproximadamente a mesma massa: 1,67 X 10-27 kg • Elétrons possuem massa muito menor: 9,11 X 10-31 kg
- 27. CONCEITOS SOBRE O ÁTOMO Número Atômico (Z): quantidades de prótons. Z=p=e Número de Massa (A): a soma das partículas que constitui o átomo. A=Z+n+e A=Z+n REPRESENTAÇÃO DE UM ÁTOMO
- 28. DISTRIBUIÇÃO ELETRONICA EM ORBITAIS: PRINCIPIO DA EXCLUSÃO DE PAULI: um orbital comporta no máximo dois elétrons com spins contrários. REGRA DE HUND: em um mesmo subnível os orbitais são preenchidos de forma a obter o maior número de elétrons desemparelhados.
- 30. d
- 31. Formas dos orbitais s e p
- 32. Formas dos orbitais d
- 33. Formas dos orbitais f
- 34. SEMELHANÇA ATÔMICA ISÓTOPOS: mesmo número de prótons. ISÓBAROS: mesmo número de massa. ISÓTONOS: mesmo número de nêutrons.
- 35. ISOELETRONICOS: mesmo número de elétrons. ÍONS: são átomos que ganharam ou perderam elétrons
- 36. As partículas fundamentais do átomo
- 37. As partículas fundamentais Temos então um total de 12 leptons, 36 quarks, 12 mediadores e uma partícula de Higgs, fazendo um total de 61 partículas elementares fundamentais.
- 38. Prótons e nêutrons são formados de quarks
- 39. Antimatéria não é ficção • Cada partícula tem outra equivalente com massa igual e carga contrária. • Elétron de carga negativa Pósitron com carga positiva. • Próton de carga positiva Antipróton. • Os cientista já conseguiram aprisionar a antimatéria do átomo de hidrogênio por 16 minutos
- 40. Matéria e antimatéria não coexistem. • Quando se encontram, geram uma explosão que transforma massa em energia. • A ciência acredita que ambas existiam em quantidades iguais quando ocorreu o Big Bang, mas se destruíram. • Por alguma razão, sobrou mais matéria - que se moldou e formou planetas, galáxias e estrelas
- 41. Opostos se destroem • A explosão causada pelo encontro da matéria e da antimatéria gera raio gama - que possui 10 mil vezes mais energia que o raio solar e o raio X. • Só para ter uma ideia, 1 g de antimatéria seria capaz de abastecer a cidade de São Paulo durante 24 horas ou mover um carro por 10 mil Km.
- 42. Pósitron para detectar tumores • A antimatéria já é utilizada em exames médicos. Um exemplo é o PET Scan - Pósitron Emission Tomography -, que utiliza antielétrons (pósitrons) para detectar tumores cancerígenos.
- 43. Grandezas químicas: Massa atômica, massa molecular e mol
- 44. Unidade de Massa Atômica (u ou u.m.a.) • Para medir as massas dos átomos, os químicos escolheram como padrão a massa de um átomo. • Em 1962, durante o Congresso Internacional de Química, foi escolhido o átomo de carbono 12 (12C), e a unidade usada na medida das massas atômicas passou a ser massa de 1/12 do átomo de carbono 12. • Este padrão é chamado de unidade de massa atômica.
- 45. Unidade de Massa Atômica (u ou u.m.a.) • O carbono 12 (6C12) apresenta 6 prótons e 6 nêutrons. • Como a massa de um próton é praticamente igual a massa de um nêutron, esse carbono é constituído por 12 unidades, praticamente iguais em massa, que constituem sua massa total. Assim, a unidade de massa atômica (u ou u.m.a.) representa a massa de um próton ou de um nêutron: 1u ou 1u.m.a. = 1/12 do carbono 12
- 46. Massa atômica • Massa atômica é a massa de um átomo expressa em u ou u.m.a. Ela indica quantas vezes a massa do átomo é maior que 1/12 da massa do carbono 12. Assim, a massa atômica do carbono 12 é igual a 12u. Por exemplo, quando dizemos que a massa do átomo 24Mg é igual a 24u, concluímos que: Massa de um átomo de 24Mg = 24 x massa de 1/12 do átomo de 12C. Massa de um átomo de 24Mg = 2 x massa de um átomo de 12C.
- 47. Massa atômica de um elemento • Massa atômica de um elemento é a média ponderada das massas atômicas de seus isótopos constituintes. Exemplo: o elemento químico cloro é formado pelos isótopos: 17 Cl35 = 75% e 17 Cl37 = 25% Massa atômica do elemento cloro = [(35 x 75) + (37 x 25)] / 100 = 35,5u
- 48. Em grandezas sub-microscópicas • Observe a massa atômica dos seguintes elementos químicos: He = 4u → massa de 1 átomo de hélio • C = 12u → massa de 1 átomo de carbono Ca = 40u → massa de 1 átomo de cálcio
- 49. Em grandezas macroscópicas • Consideremos os mesmos números, mas em uma grandeza macroscópica. Experimentalmente os químicos determinaram que a quantidade de átomos presentes nos três casos é exatamente a mesma: 4g de He contém 6,02 x 1023 átomos de He 12g de C contém 6,02 x 1023 átomos de C 40g de Ca contém 6,02 x 1023 átomos de Ca Assim como 12 unidades é uma quantidade chamada 1 dúzia, a quantidade 6,02 x 1023 unidades foi chamada de 1 mol.
- 50. Conceito de mol de número de Avogadro Tanto em laboratório como, principalmente, em escala industrial, as reações envolvem um grande número de moléculas. Um mol é a quantia de substância que possui um número de unidades fundamentais (átomos, moléculas ou outras partículas) igual ao número de átomos presente em exatamente 12 g do isótopo de carbono 12. Número de Avogadro: 6,023x1023. No sistema SI, esta unidade é o gmol (mol) 1 mol = 6,023 x 1023 moléculas Massa molar é a massa em gramas de 1 mol de átomos
- 51. Número de Avogadro • Um mol de qualquer espécie química = 6,02 x 1023 entidades elementares da referida espécie química. Por exemplo: 1 mol de átomos = 6,02 x 1023 átomos 1 mol de moléculas = 6,02 x 1023 moléculas 1 mol de íons = 6,02 x 1023 íons O número 6,02 x 1023 é conhecido como constante de Avogadro.
- 52. Massa molecular • Massa molecular de uma substância é a massa da molécula expressa em unidade de massa atômica (u). • Numericamente, a massa molecular é igual a soma das massas atômicas (encontradas na Tabela Periódica) de todos os átomos constituintes da molécula.
- 53. Exemplo • Exemplo: Calcular a massa molecular da água (H2O): 2H = 2 x 1 = 2u 1O = 1 x 16 = 16u Somando as massas: 2u + 16u = 18u Assim, a molécula da água tem massa molecular igual a 18u. No caso de substâncias iônicas, o termo massa molecular deve ser substituído por fórmula-massa (ou massa- fórmula), pois não existe molécula de substância iônica. • Entretanto, na prática costuma-se usar a expressão massa molecular também nesses casos.
- 54. Massa molar Massa molar é a massa contida em 1 mol (que contém 6,02 x 1023 unidades) de qualquer espécie química. A unidade mais usada para a massa molar é g/mol ou g * mol – 1.
