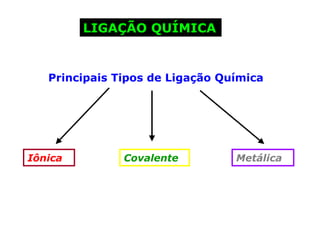
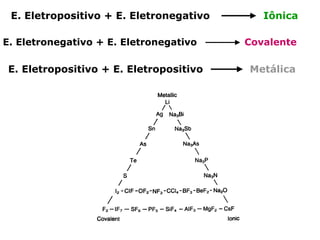
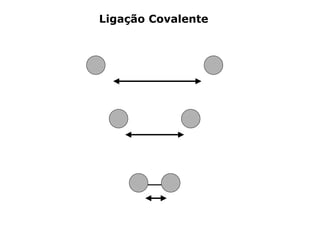
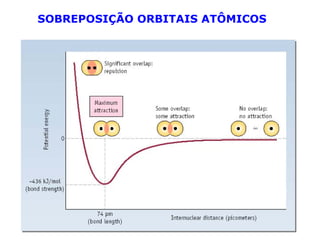
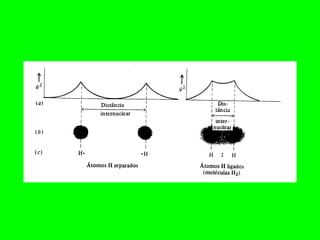
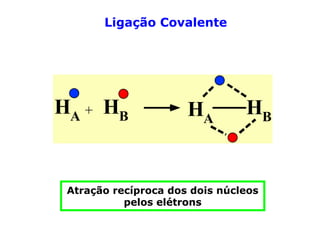
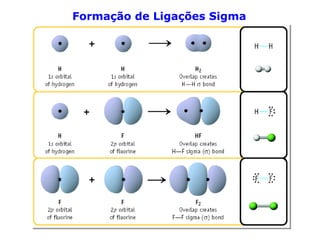
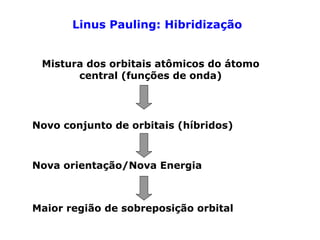
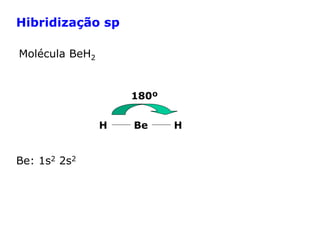
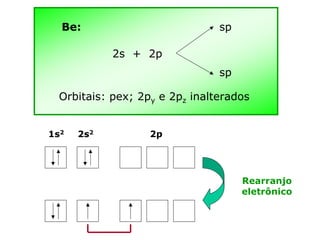
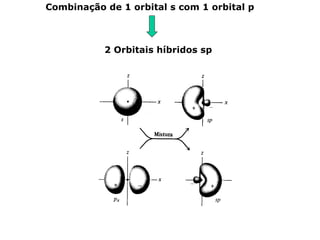
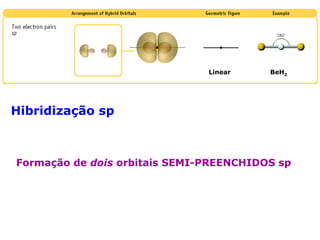
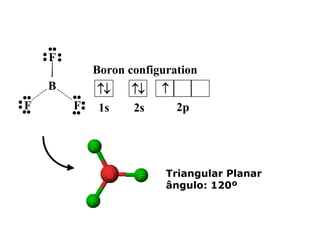
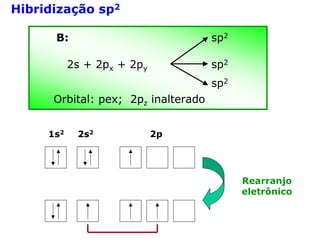
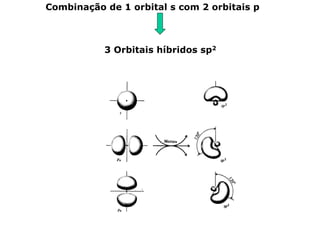
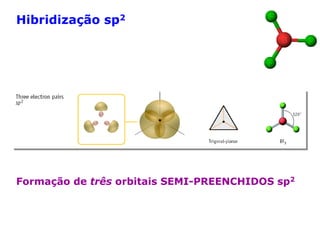
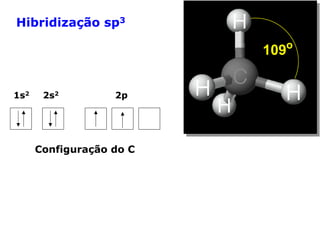
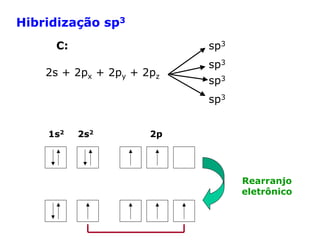
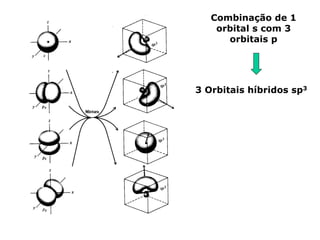
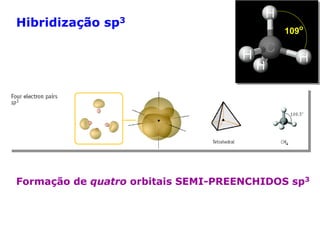
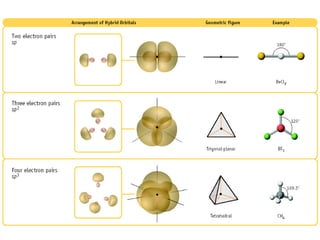
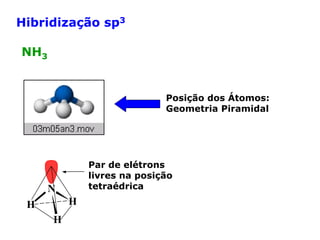
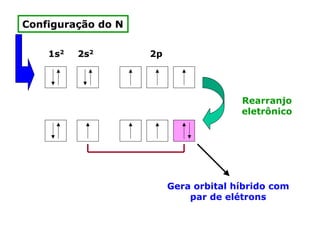
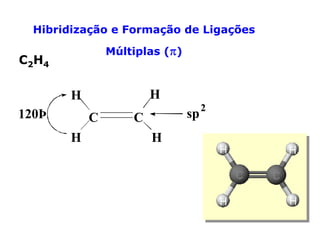
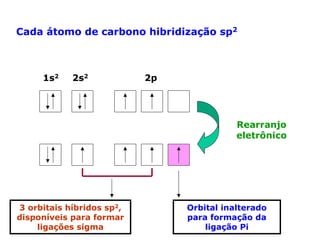
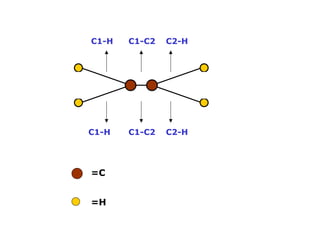
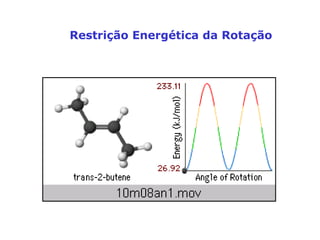
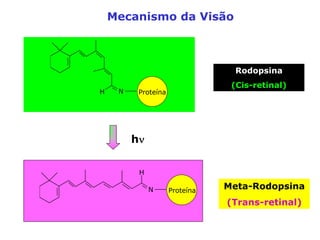
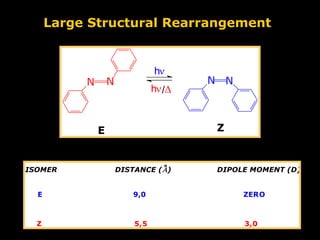
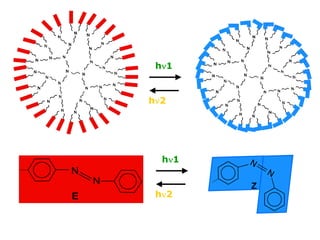
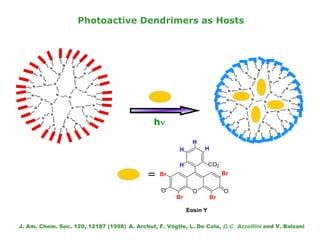
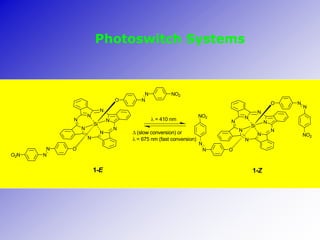
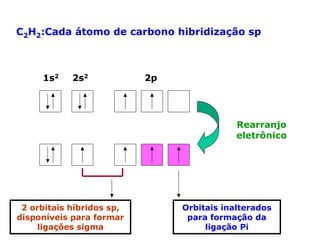
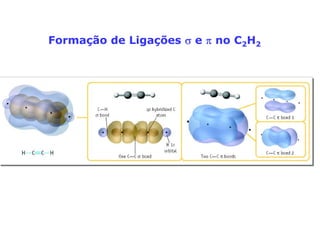
O documento descreve a Teoria da Ligaçao de Valência (TLV) proposta por Linus Pauling para explicar a formação de ligações químicas. A TLV envolve a sobreposição de orbitais atômicos semi-preenchidos dos átomos ligados, localizando os elétrons de valência entre os núcleos. O conceito de hibridização é introduzido para explicar a geometria de moléculas com mais de um centro reativo, como a formação de orbitais híbridos sp, sp2 e sp3.