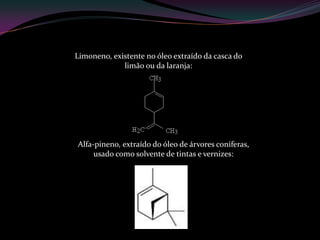
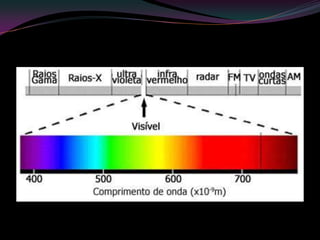
O documento discute hidrocarbonetos insaturados como alcinos e alquinos. Apresenta as propriedades e aplicações do acetileno e isopreno. Explica a relação entre estrutura molecular e cor em substâncias como o beta-caroteno. Também aborda o processo de vulcanização da borracha.