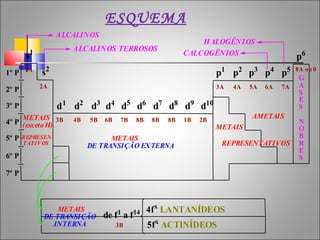
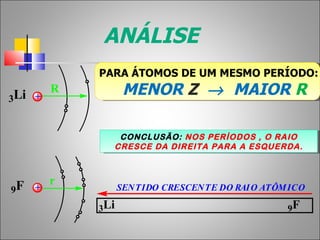
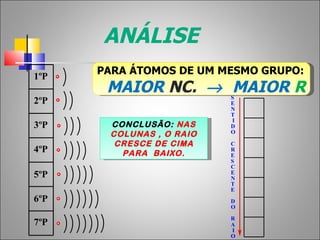
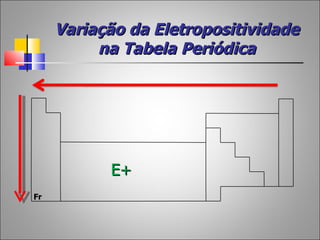
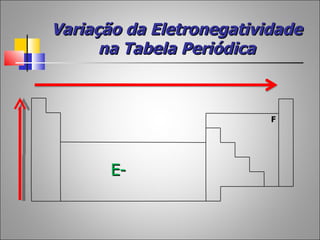
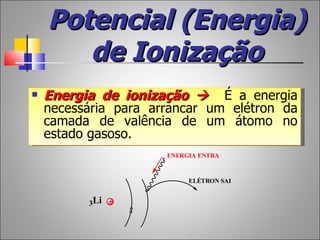
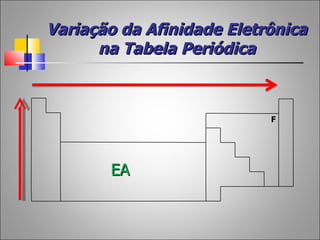
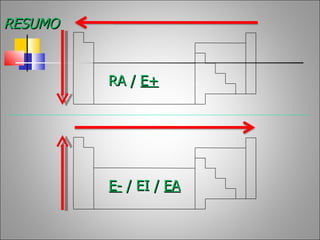
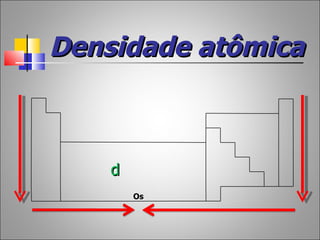
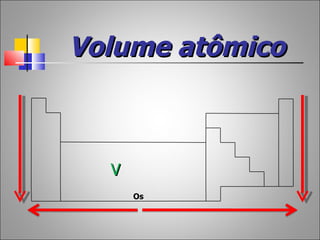
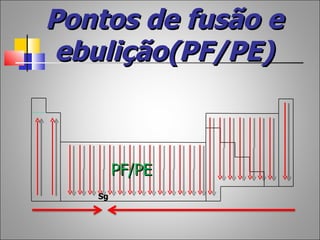
1) O documento descreve a história da Tabela Periódica desde as primeiras tentativas de classificar os elementos químicos até a versão moderna baseada no número atômico.
2) Johann Döbereiner, Alexandre Béguyer de Chancourtois e John Newlands realizaram alguns dos primeiros trabalhos de classificação dos elementos de acordo com suas propriedades.
3) Dimitri Mendeleev e, posteriormente, Henry Moseley estabeleceram as bases da tabela periódica moderna, organizando os elementos de acordo com suas mass