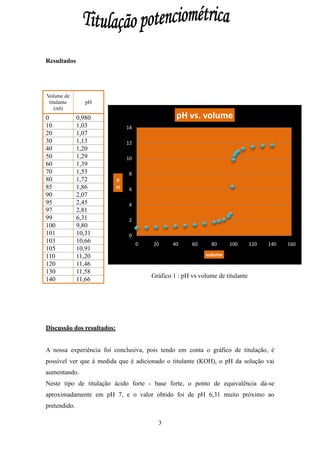
Este documento descreve uma experiência de titulação potenciométrica realizada para determinar a concentração de uma solução de ácido clorídrico desconhecida. A titulação envolveu adicionar gradualmente uma solução de hidróxido de potássio a uma amostra de ácido clorídrico, medindo o pH após cada adição. O gráfico de pH vs volume de titulante mostrou um ponto de inflexão em pH 6,31, indicando o ponto de equivalência e permitindo calcular a concentração da solução de