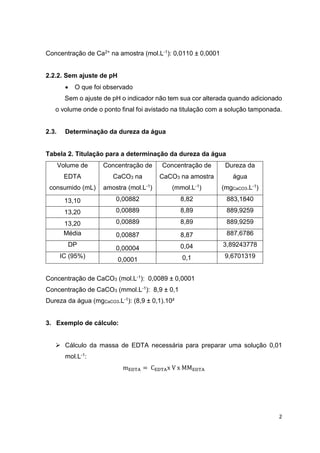
Este relatório descreve experimentos de complexometria para determinar a concentração de cálcio em uma amostra de água e sua dureza. A concentração de cálcio foi medida em 0,0110 ± 0,0001 mol/L e a dureza da água foi de 890 ± 10 mgCaCO3/L, acima do limite permitido.