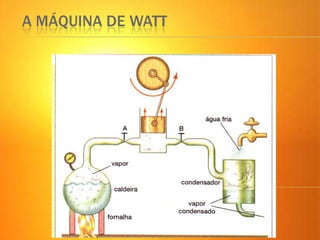
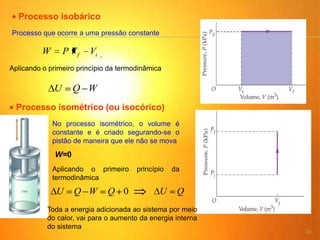
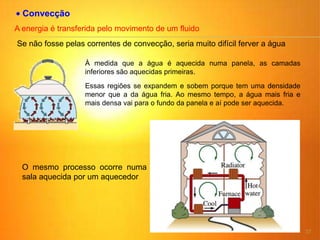
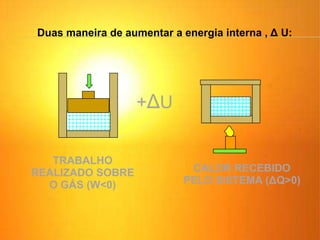
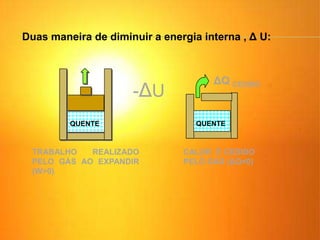
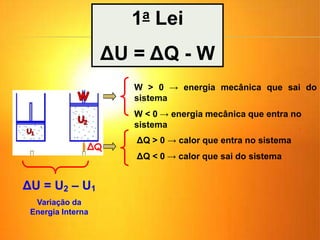
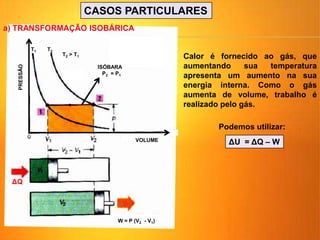
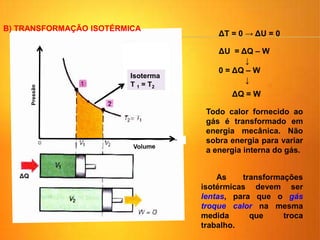
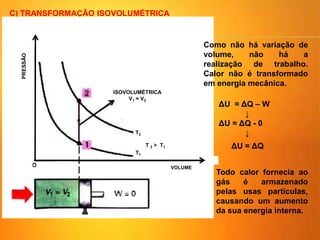
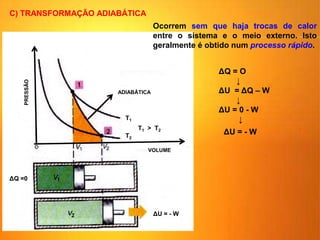
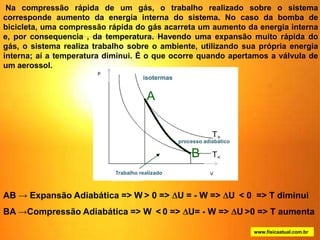
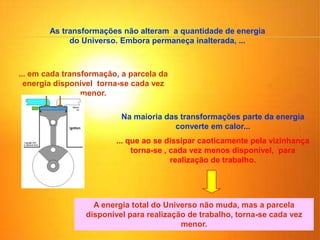
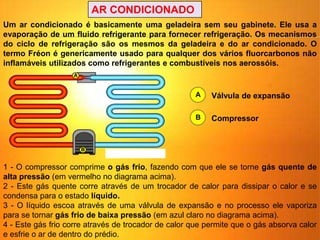
1) O documento discute os conceitos básicos da termodinâmica, incluindo a história da máquina térmica, definições de energia, as leis da termodinâmica e exemplos de máquinas térmicas como a máquina de Watt e turbinas a vapor.
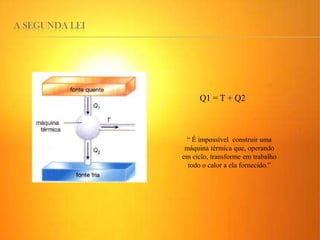
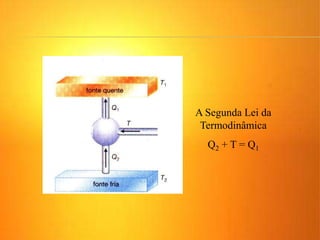
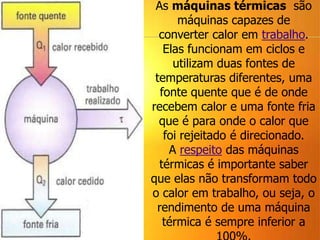
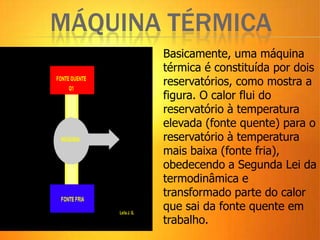
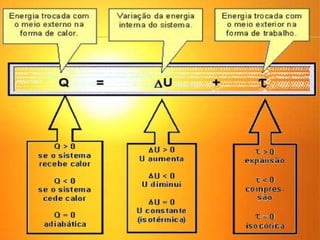
2) A Segunda Lei da Termodinâmica estabelece que é impossível construir uma máquina térmica que converta todo o calor em trabalho. Máquinas térmicas sempre terão alguma perda de calor para o me





















![Então, de acordo com a Segunda Lei da
Termodinâmica, há sempre uma tendência
para as áreas quentes se resfriarem e as
áreas frias se aquecerem - assim cada vez
menos trabalho poderá ser obtido.
Até que finalmente, quando tudo
estiver numa mesma temperatura, você
não poderá mais obter nenhum trabalho
disso, mesmo que toda a energia continue
lá. E isso é verdade para TUDO em geral,
em todo o universo.“
[Isaac Asimov in The Origin of the Universe in the ORIGINS: How
the World Came to Be video series 5299 USA: Eden Communications,
1983).]](https://image.slidesharecdn.com/termodinamica2013-130626213120-phpapp02/85/Termodinamica-2013-25-320.jpg)