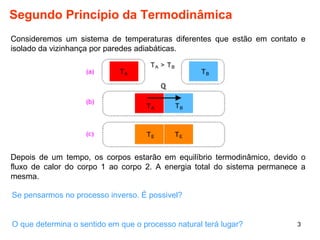
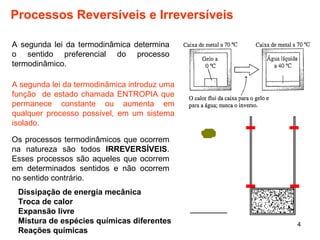
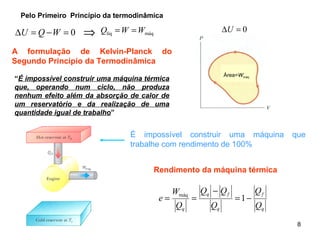
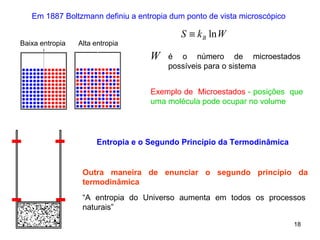
1. O documento discute máquinas térmicas e o segundo princípio da termodinâmica, incluindo processos reversíveis e irreversíveis.
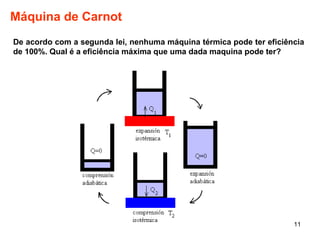
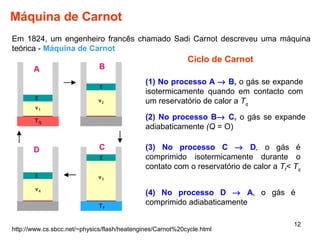
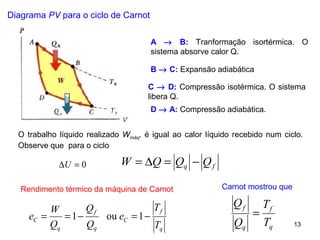
2. A máquina de Carnot é descrita como tendo a eficiência máxima possível de qualquer máquina térmica.
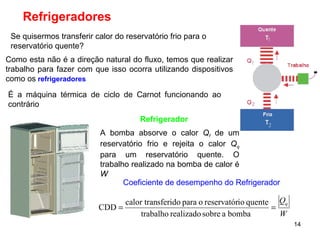
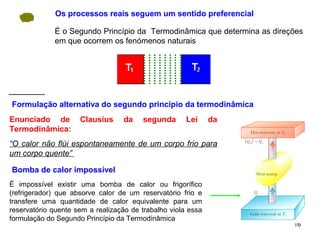
3. Refrigeradores e bombas de calor são discutidos em relação ao segundo princípio, sendo impossível criar uma bomba de calor que transfira calor de um reservatório frio para um quente sem trabalho.