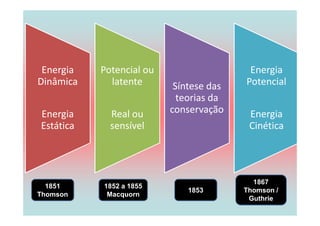
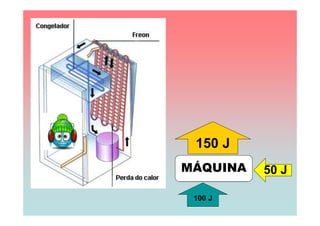
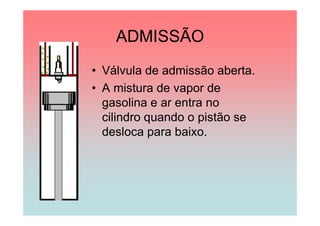
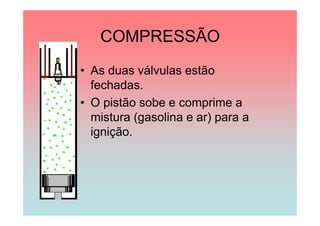
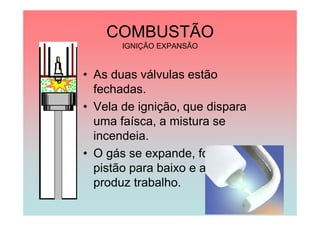
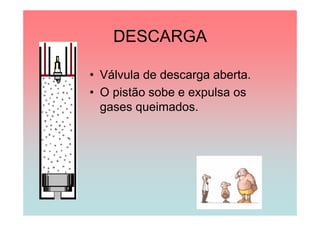
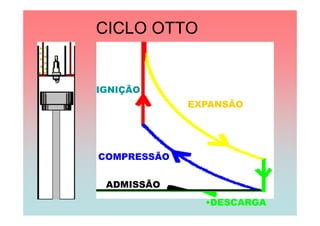
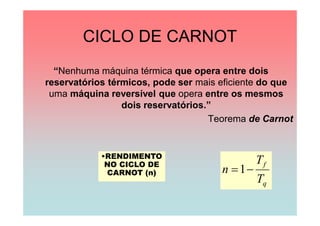
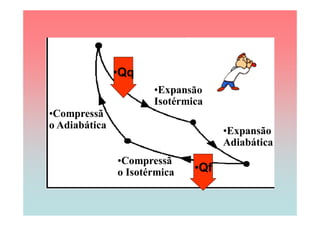
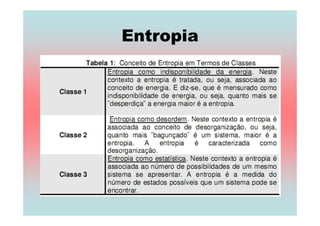
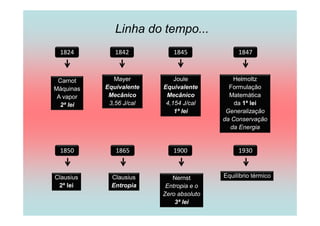
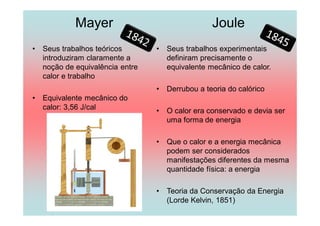
O documento apresenta uma linha do tempo de importantes contribuições para o desenvolvimento da Termodinâmica entre 1824-1930, incluindo descobertas de Carnot, Mayer, Joule, Clausius, Boltzmann e Nernst. As principais descobertas foram a formulação da primeira e segunda lei da termodinâmica, o conceito de entropia, e o estabelecimento do zero absoluto de temperatura.








![“[...] chegamos a conclusão de que a natureza como um todo
possui um estoque de energia que não pode de forma
alguma ser aumentado ou reduzido; e que, por conseguinte,
a quantidade de energia na natureza é tão eterna e
inalterável como a quantidade de matéria. Expressa desta
forma, chamei esta lei geral de Principio da Conservação da
Energia”
Herman Von Helmholtz](https://image.slidesharecdn.com/termodinmica-110913192112-phpapp01/85/Termodinamica-16-320.jpg)