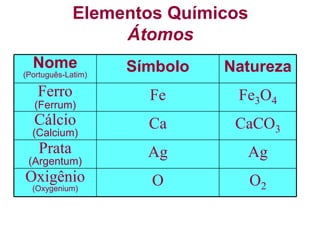
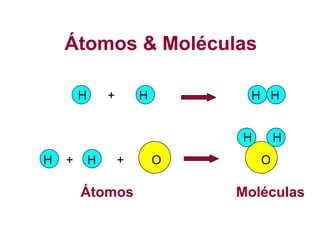
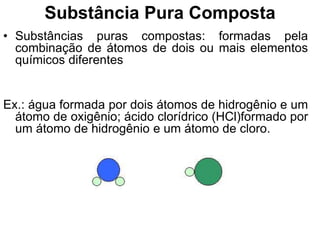
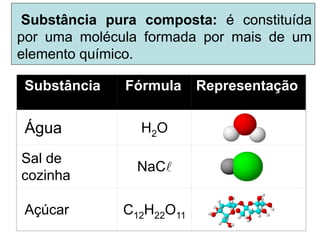
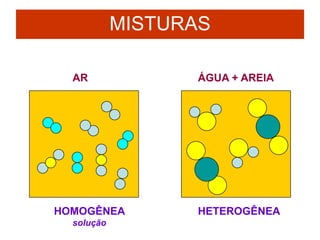
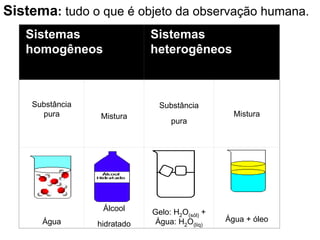
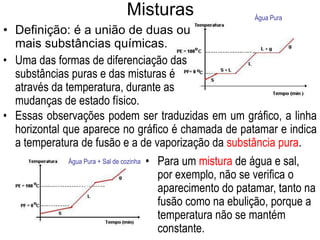
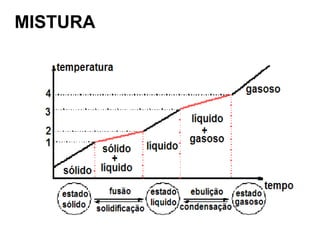
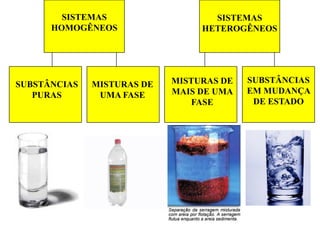
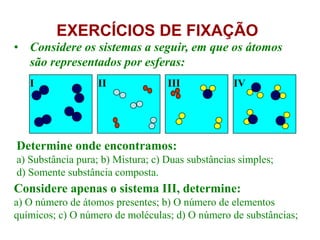
O documento discute as características de substâncias puras e misturas. Apresenta exemplos de substâncias puras simples e compostas, e explica a diferença entre misturas homogêneas e heterogêneas. Também aborda conceitos como sistemas homogêneos e heterogêneos, e os diferentes tipos de mudanças de estado da matéria.