O documento fornece informações sobre:
1) Uma apostila sobre dependência química que inclui detalhes sobre uma avaliação com prova e pesquisa escrita.
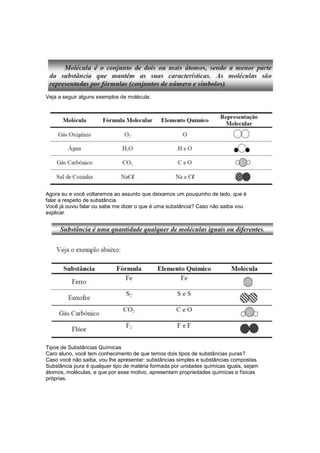
2) Conceitos básicos de química como elementos, moléculas, substâncias simples e compostas.
3) Estados físicos da matéria, pontos de fusão e ebulição, e exemplos de misturas homogêneas e heterogêneas.