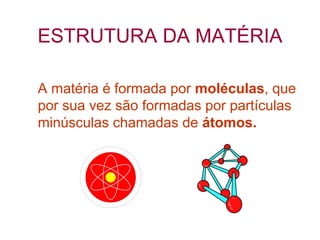
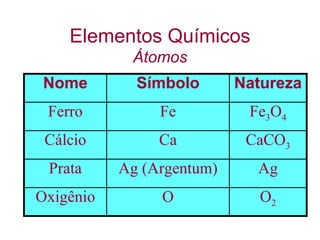
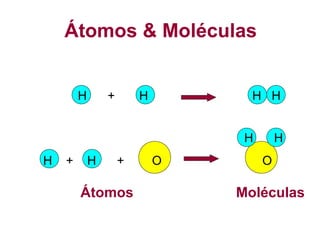
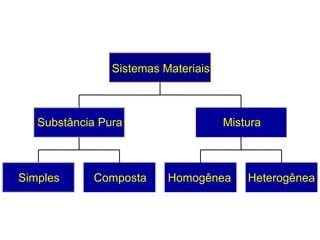
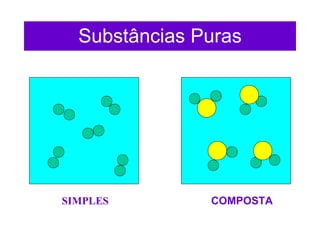
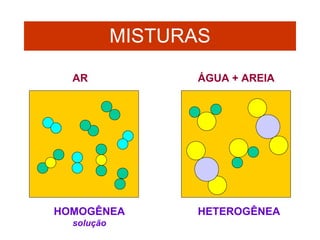
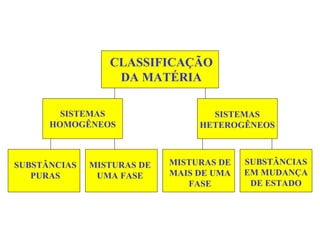
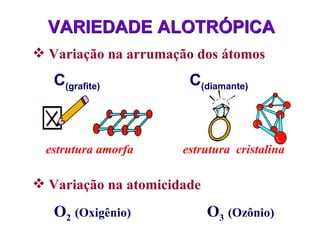
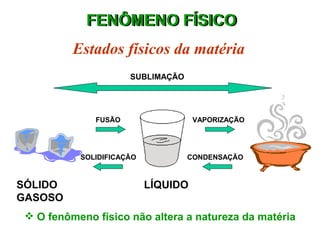
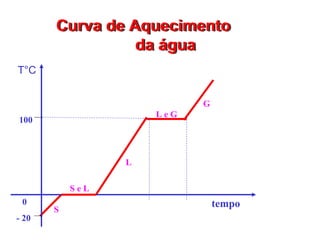
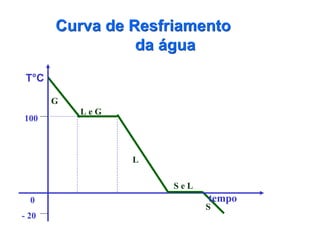
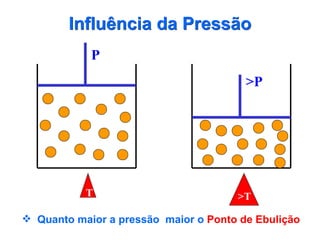
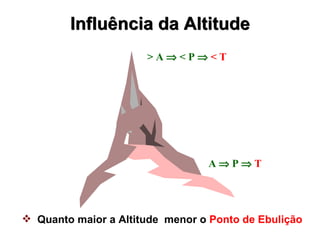
O documento fornece uma introdução abrangente sobre química, incluindo: 1) Química é uma ciência experimental que estuda a estrutura, composição e transformação da matéria; 2) A matéria é formada por átomos que se combinam para formar moléculas e elementos químicos; 3) Existem diferentes tipos de sistemas materiais como substâncias puras, misturas, sistemas homogêneos e heterogêneos.