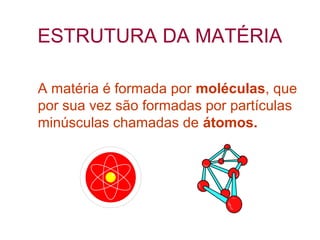
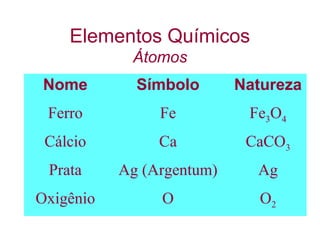
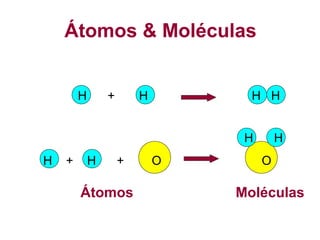
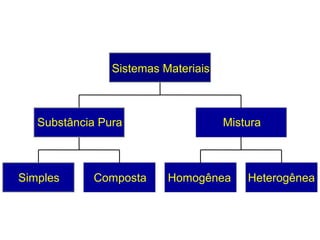
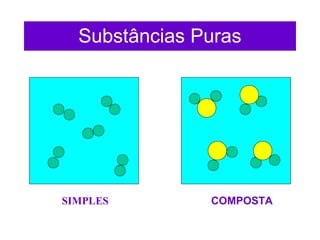
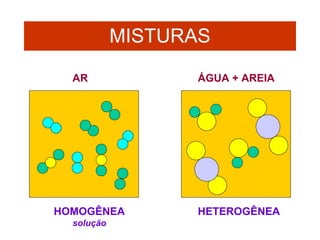
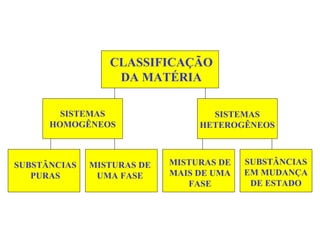
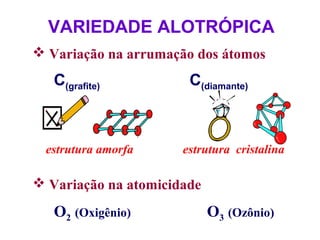
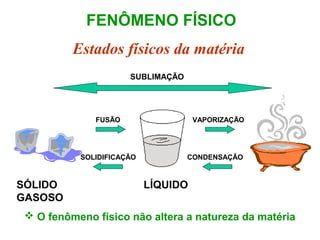
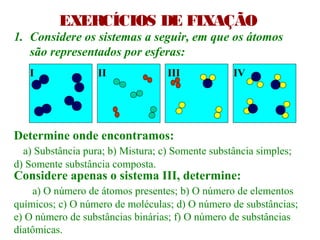
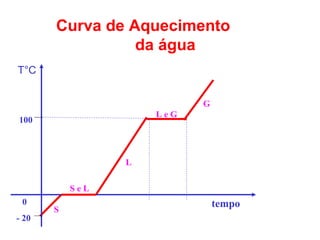
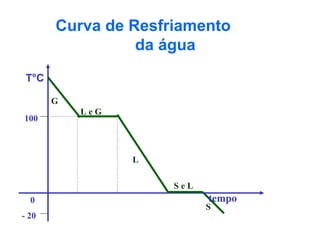
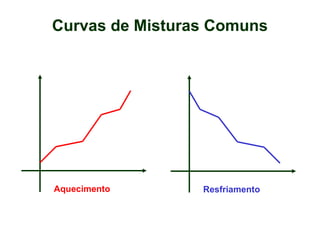
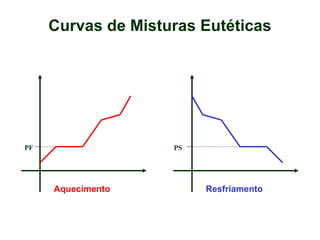
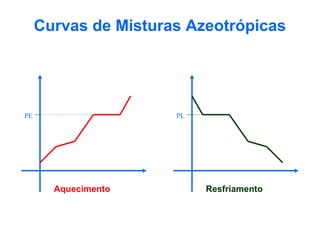
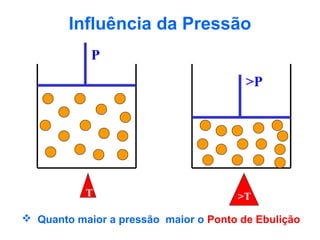
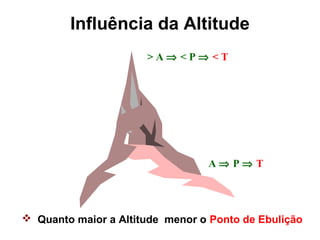
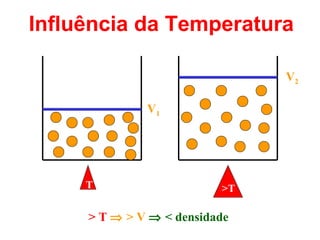
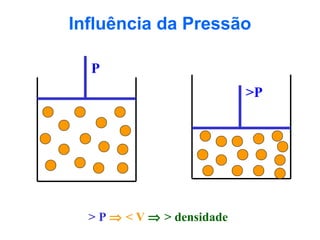
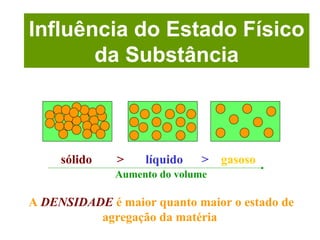
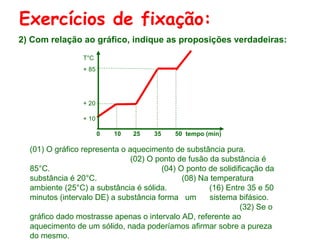
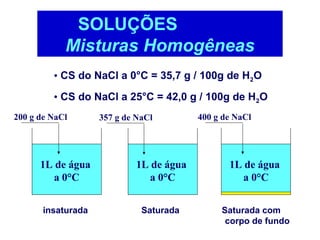
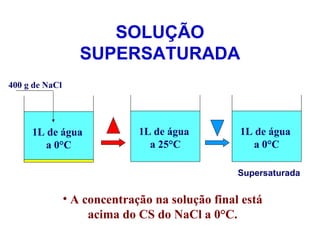
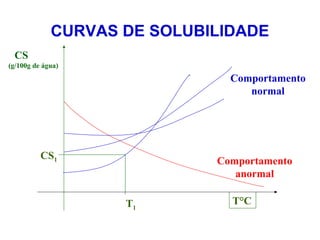
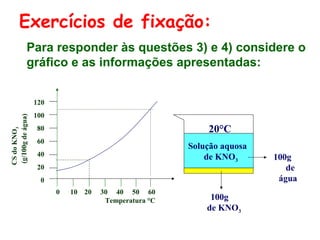
O documento apresenta conceitos básicos da química, incluindo: (1) Química é uma ciência experimental que estuda a estrutura, composição e transformação da matéria; (2) A matéria é formada por moléculas compostas por átomos; (3) Existem diferentes tipos de sistemas materiais como substâncias puras e misturas.