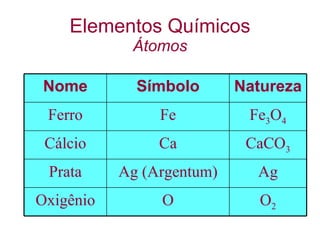
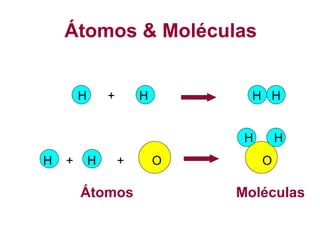
1) O documento discute as propriedades básicas da matéria, incluindo átomos, moléculas, elementos químicos, substâncias puras e misturas.
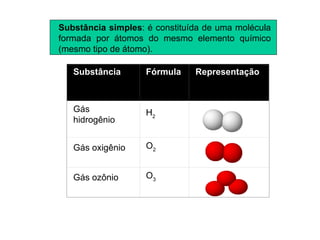
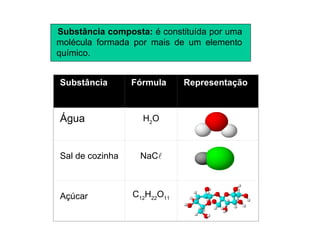
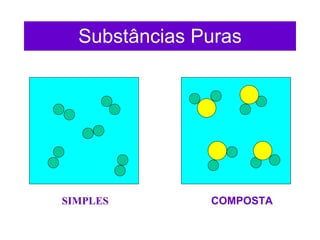
2) Existem duas categorias de substâncias: substâncias simples formadas por um único tipo de átomo, e substâncias compostas formadas por mais de um tipo de átomo.
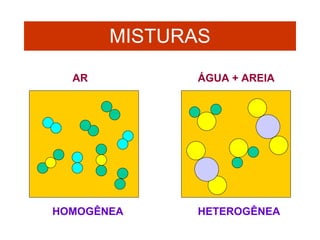
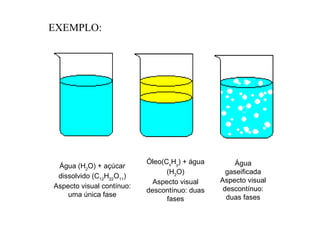
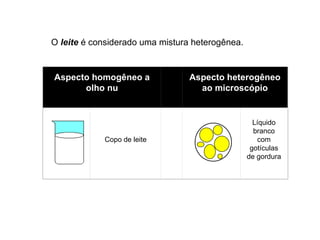
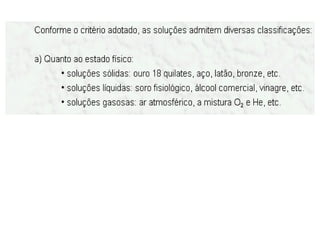
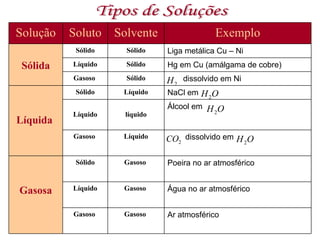
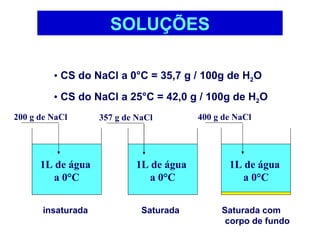
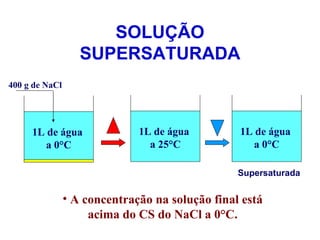
3) Misturas podem ser homogêneas ou heterogêneas dependendo de terem uma ou mais fases, e soluções são um tipo específico de mistura homogênea.