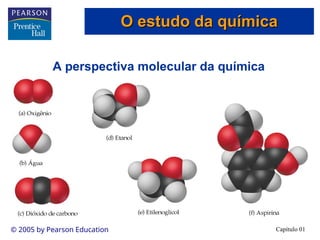
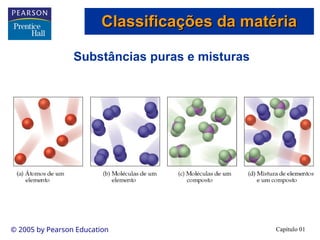
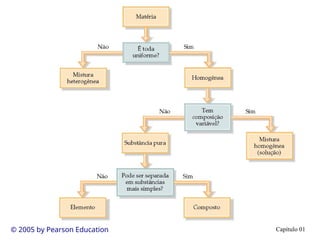
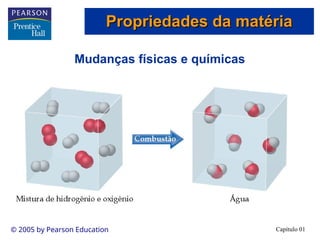
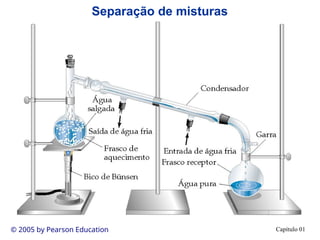
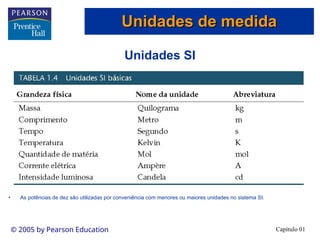
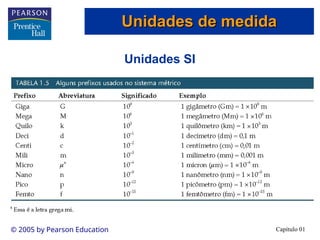
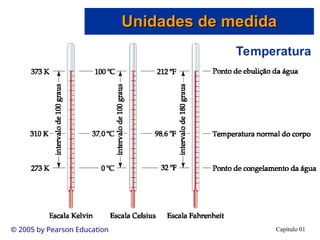
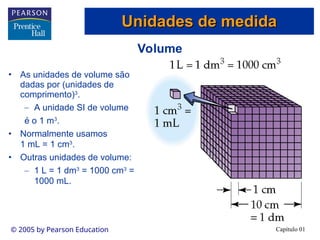
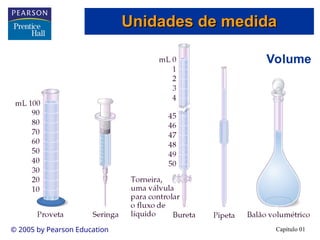
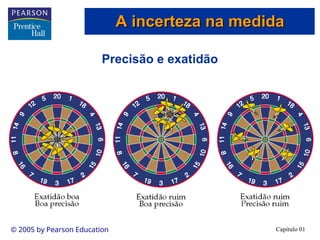
O documento introduz conceitos fundamentais de química, definindo matéria como composta de átomos e moléculas, e discutindo os três estados da matéria: sólido, líquido e gasoso. Também aborda a classificação de substâncias puras e misturas, proporcionando uma visão geral sobre elementos, compostos e suas propriedades. Além disso, menciona métodos de separação de misturas e unidades de medida, incluindo a importância da precisão nas medições científicas.