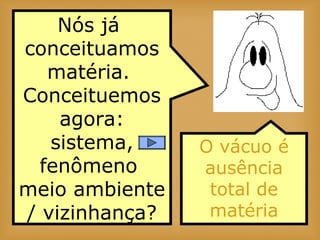
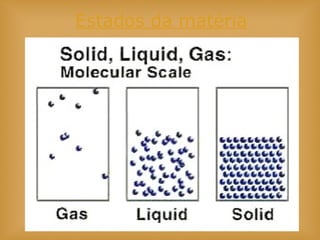
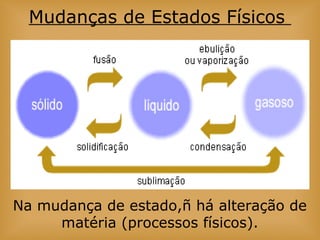
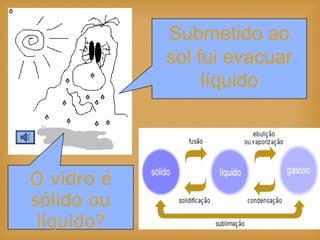
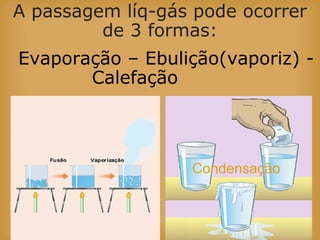
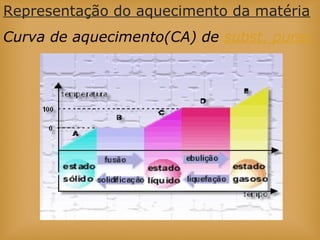
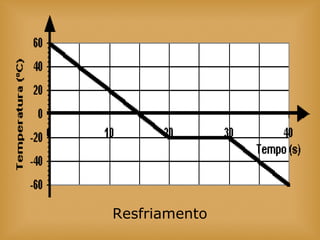
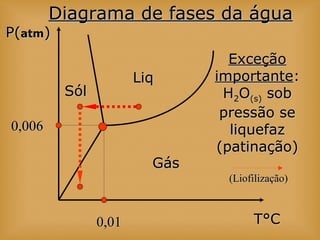
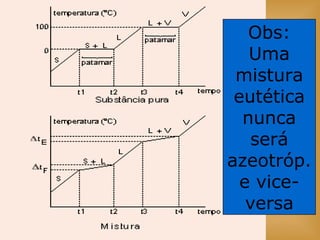
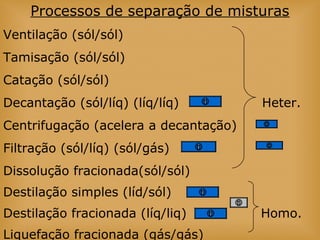
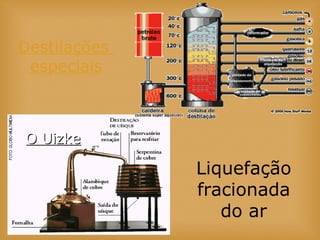
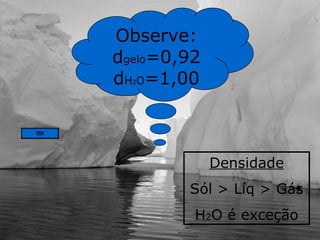
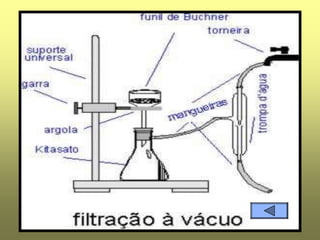
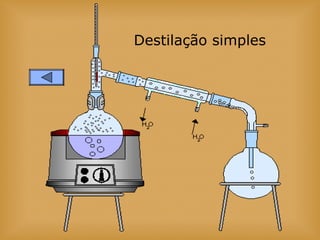
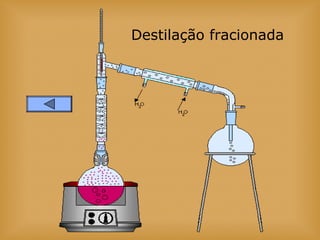
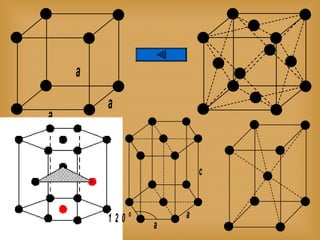
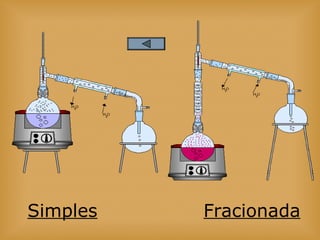
O documento discute vários tópicos relacionados à matéria e suas propriedades, incluindo: 1) os diferentes estados físicos da matéria (sólido, líquido e gás); 2) processos de mudança de estado como evaporação e condensação; 3) densidade e flutuabilidade; 4) misturas homogêneas e heterogêneas.