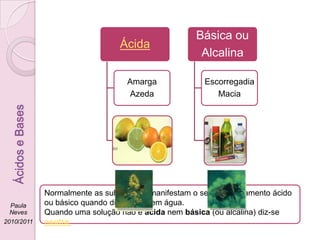
1) O documento discute a classificação de substâncias como ácidas ou básicas com base em sua sensação no gosto ou pele e seu comportamento químico quando dissolvidas em água.
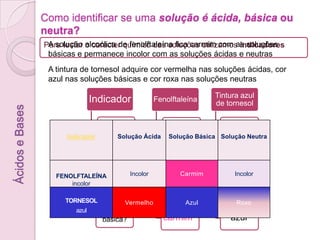
2) Indicadores químicos como fenolftaleína e tornesol mudam de cor dependendo se uma solução é ácida, básica ou neutra e são usados para testar o caráter químico de soluções.
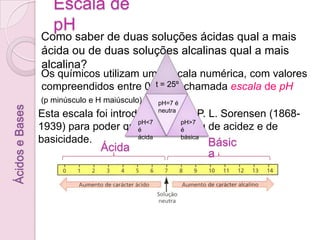
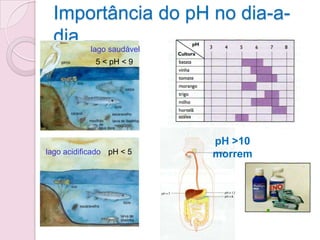
3) A escala de pH quantifica o grau de acidez ou basicidade de uma solução em uma escala