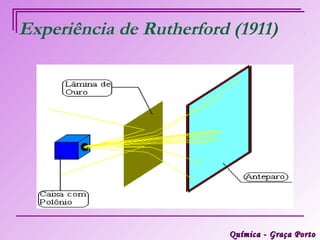
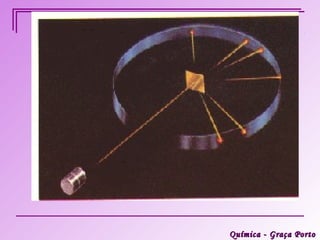
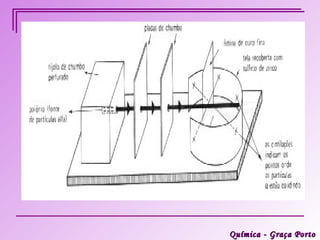
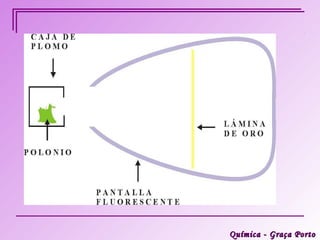
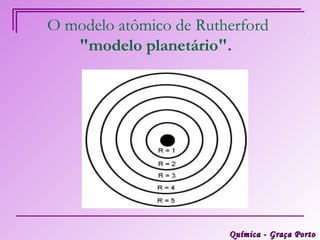
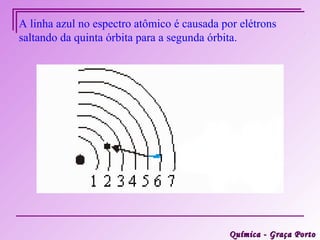
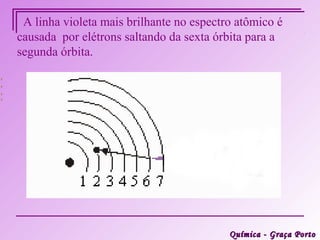
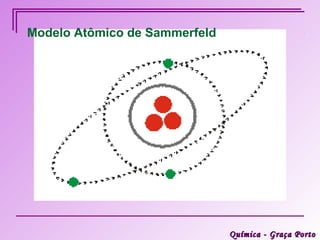
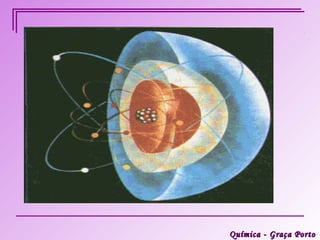
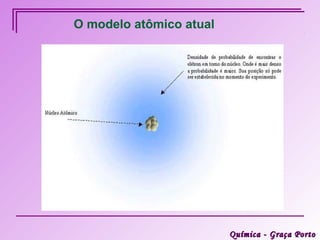
Este documento descreve a evolução histórica do modelo atômico, começando pelas ideias iniciais de Demócrito e Leucipo na Grécia Antiga sobre a existência de átomos indivisíveis. Posteriormente, o documento aborda as contribuições de Dalton, Thomson, Rutherford, Bohr e Sommerfeld para o desenvolvimento do modelo atômico, culminando no modelo atômico atual baseado nos princípios da mecânica quântica.