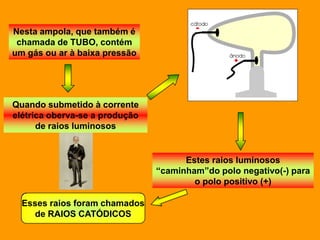
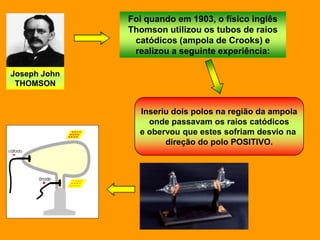
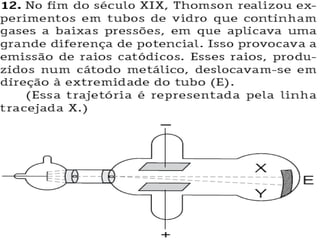
1. O documento discute os modelos atômicos de Dalton, Thomson e as partículas fundamentais do átomo como prótons, elétrons e nêutrons.
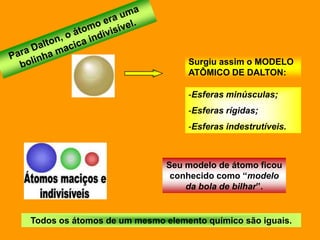
2. Dalton propôs que os átomos eram esferas minúsculas, rígidas e indestrutíveis, enquanto Thomson sugeriu que os átomos eram compostos por uma massa positiva com elétrons inseridos.
3. Os modelos atômicos evoluíram à medida que novas evidências experimentais foram encontradas, como a descoberta do el