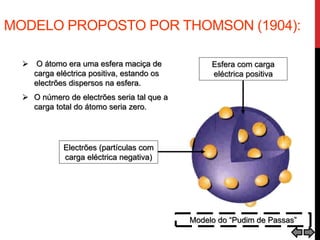
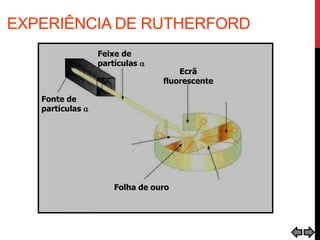
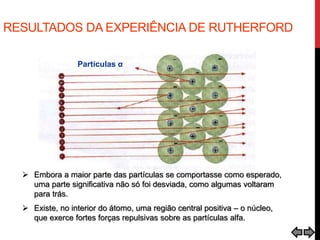
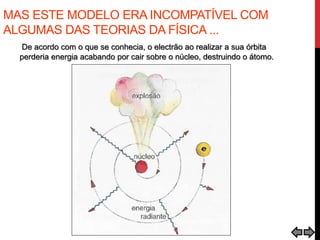
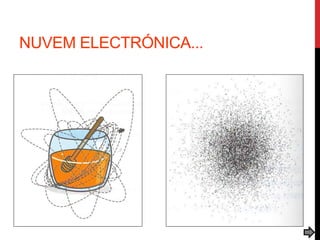
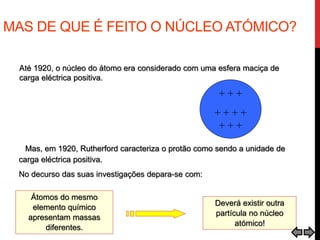
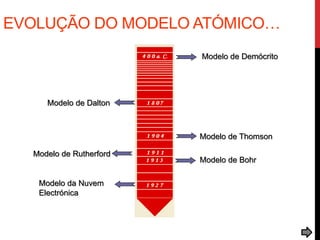
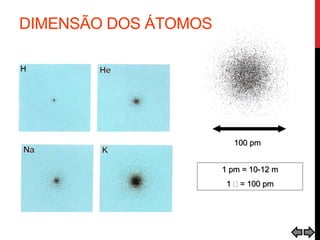
O documento explora a evolução dos modelos atômicos desde a antiguidade até o século XX, destacando contribuições de cientistas como Demócrito, Dalton, Thomson, Rutherford, Bohr e Schrödinger. Cada modelo atômico é discutido em relação aos seus princípios e limitações, culminando na descoberta do nêutron por Chadwick em 1932. Além disso, o texto menciona características específicas de elementos químicos como chumbo e néon.