1) O documento discute as propriedades dos gases e suas transformações sob condições de temperatura, pressão e volume constantes
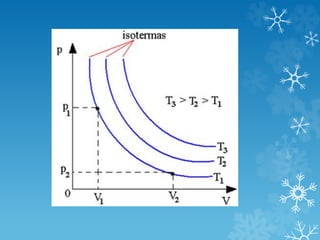
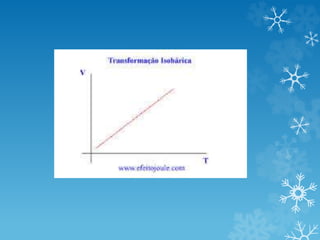
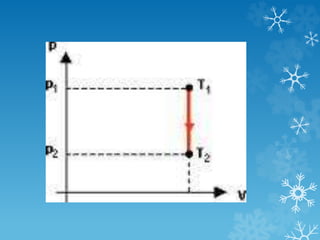
2) A equação geral dos gases relaciona essas três propriedades e descreve como elas variam em transformações isotérmicas, isobáricas e isocóricas
3) Leis de Boyle-Mariotte, Charles e Gay-Lussac descrevem como esses fatores se relacionam em cada tipo de transformação