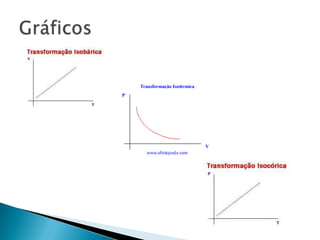
O documento discute a teoria cinética dos gases, apresentando as leis de Boyle-Mariotte, Gay-Lussac e Charles, e como elas descrevem as transformações gasosas sob condições de pressão, volume e temperatura constantes. O texto também menciona experimentos com balões de gás hélio e a importância dos gráficos para interpretar os resultados.