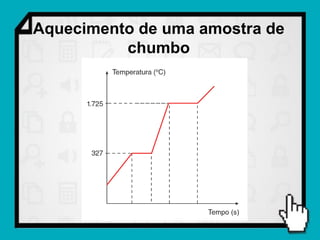
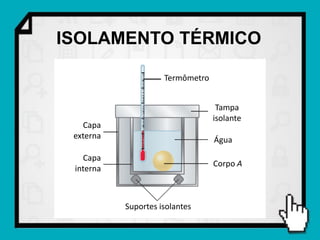
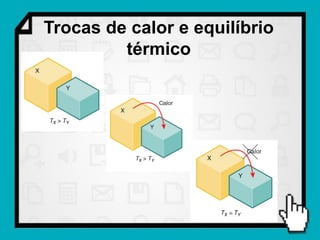
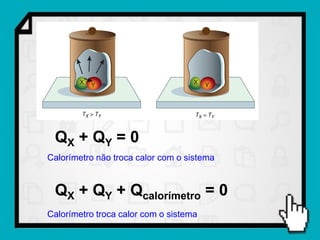
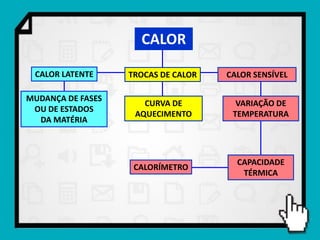
1) O documento discute conceitos fundamentais de calorimetria e trocas de calor, incluindo capacidade térmica, calor específico, equação fundamental da calorimetria e calor latente.
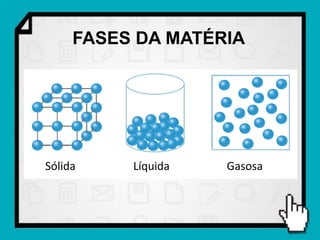
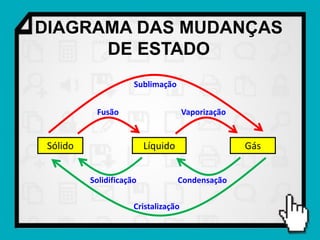
2) São explicados os diferentes estados da matéria - sólido, líquido e gasoso - e o plasma como quarto estado.
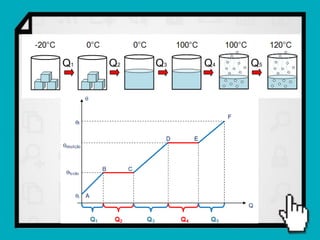
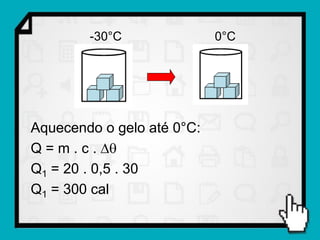
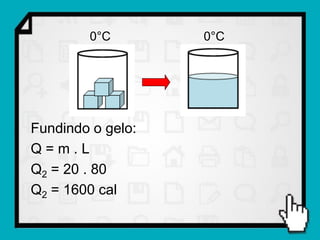
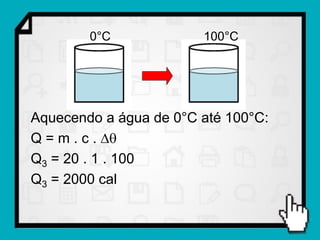
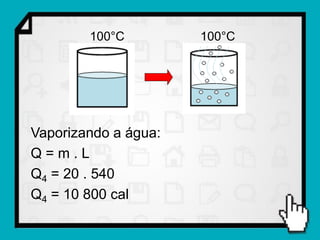
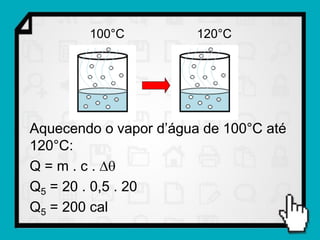
3) É mostrado um exemplo numérico de cálculo da quantidade de calor necessária para transformar gelo em vapor d'água.