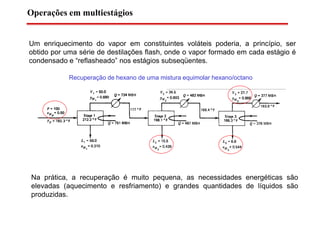
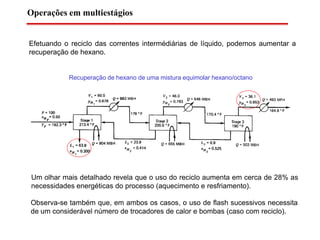
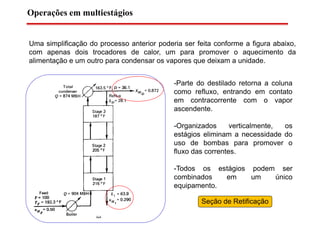
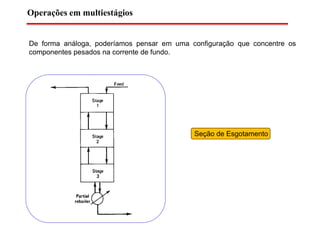
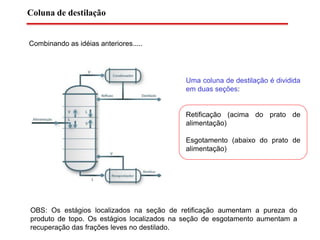
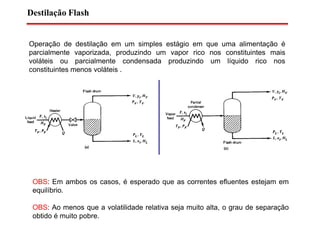
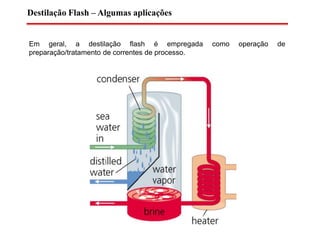
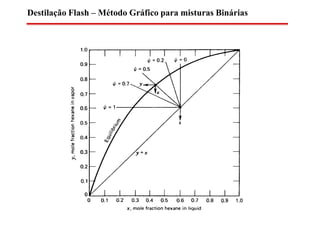
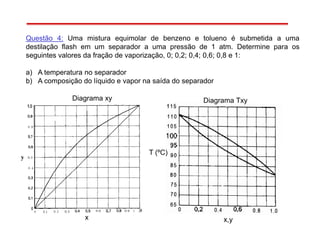
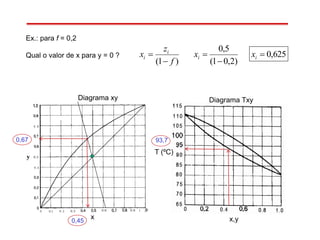
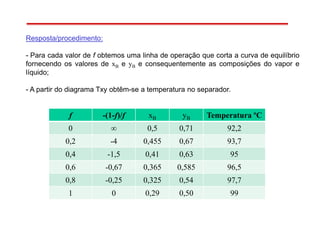
O documento descreve diferentes tipos de destilação flash, incluindo: (1) destilação flash simples em um estágio, (2) aplicações de destilação flash como tratamento de correntes de processo, e (3) equações fundamentais e métodos gráficos para determinar as composições das correntes de saída em destilação flash isotérmica para misturas binárias.




![Aplicação do Método de Newton na resolução da equação de Rachford-Rice:
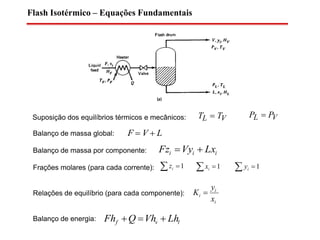
Flash Isotérmico Multicomponente – Método de Rachford and Rice
c
i i
ii
Kf
Kz
F
1 )1(1
)1(
O método de Newton calcula a melhor raiz para a função usando a última estimativa
e a razão da função e sua derivada calculadas com a ultima estimativa:
k
k
kk
fF
fF
ff
'
1
c
i i
ii
Kf
Kz
F
1
2
2
'
)]1(1[
)1(
OBS: O procedimento da forma apresentada neste texto, só deve ser empregado
para casos em que os coeficientes de distribuição (K) podem ser considerados
independentes da composição.](https://image.slidesharecdn.com/aula02-150412204557-conversion-gate01/85/Aula-02-12-320.jpg)



![
2
2
2
2
2
2
2
2
'
]134,01[
34,014,0
]174,01[
74,013,0
]175,11[
75,112,0
]12,41[
2,411,0
ffff
fF
Método de Newton para estimativa do novo valor de f .
k
k
kk
fF
fF
ff
'
1
c
i i
ii
Kf
Kz
F
1
2
2
'
)]1(1[
)1(
6259,0
]134,05,01[
34,014,0
]174,05,01[
74,013,0
]175.15,01[
75,112,0
]12,45,01[
2,411,0
5,0 2
2
2
2
2
2
2
2
'
F
0982,0
6259,0
2515,0
5,01
k
f](https://image.slidesharecdn.com/aula02-150412204557-conversion-gate01/85/Aula-02-16-320.jpg)