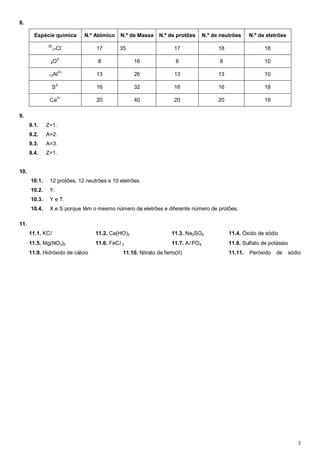
1. O documento contém respostas para uma ficha de trabalho sobre elementos químicos, incluindo isótopos, números atómicos, de massa e eletrões.
2. É fornecida a resolução de exercícios sobre a caracterização de átomos e iões com base nos seus números atômicos, de massa e eletrões.
3. A tabela resume as propriedades de diferentes espécies químicas como o número atômico, de massa, de protões, neutrões e eletrões.