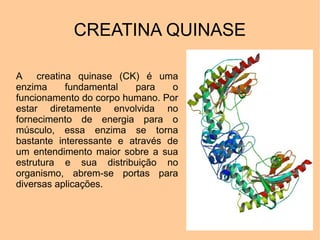
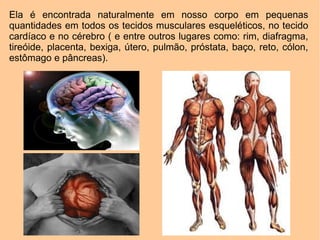
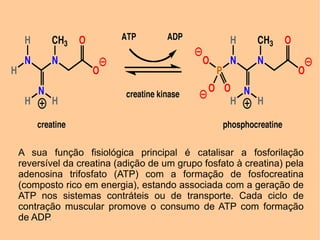
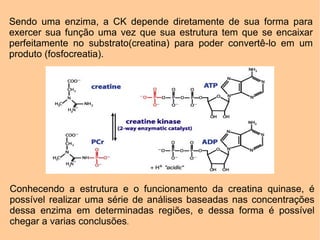
[1] A creatina quinase (CK) é uma enzima fundamental que catalisa a fosforilação reversível da creatina para fornecer energia aos músculos. [2] A CK é encontrada principalmente nos músculos e coração, onde ajuda na geração de ATP durante a contração muscular. [3] Níveis elevados de CK no sangue podem indicar danos musculares ou cardíacos.