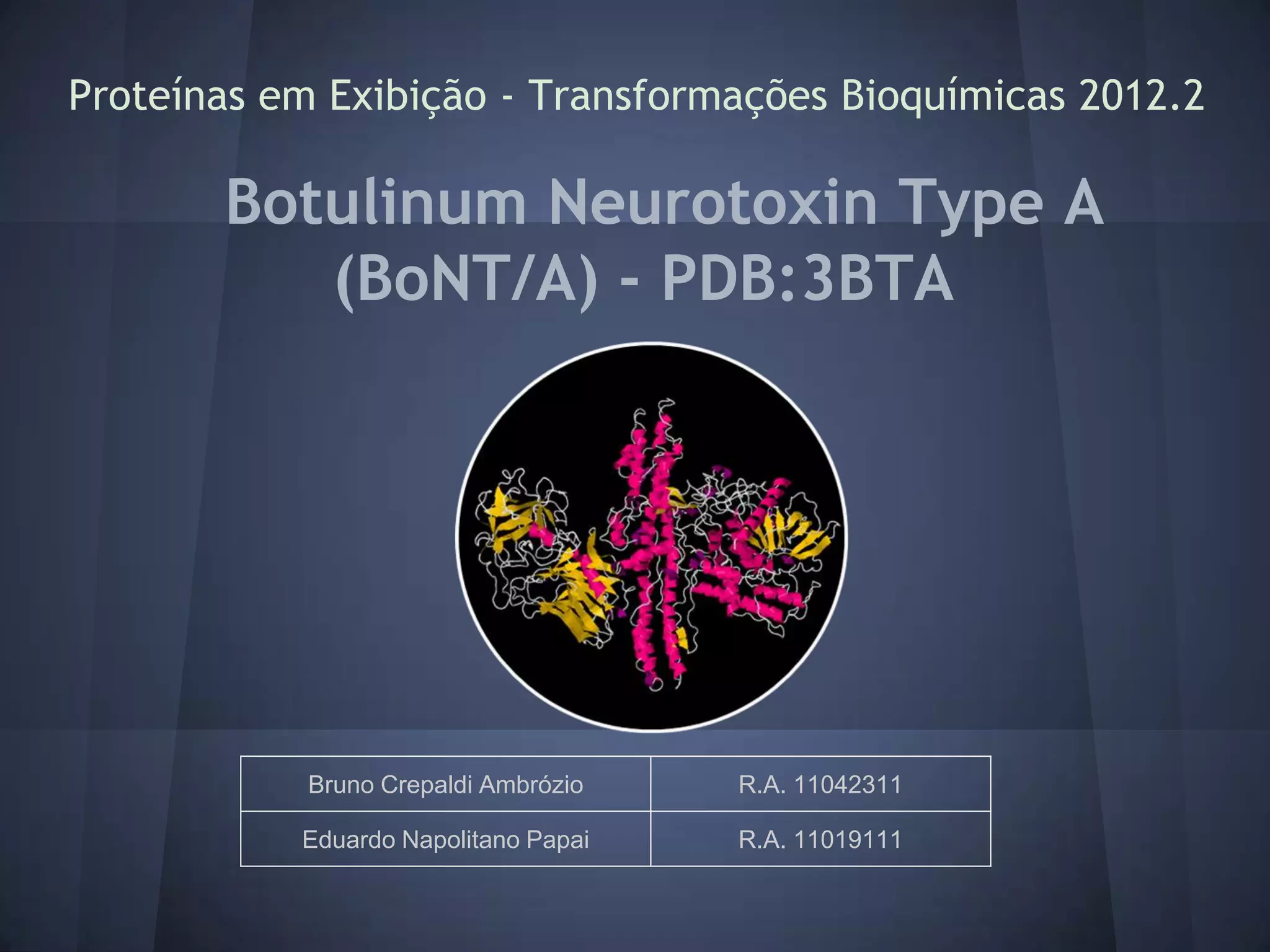
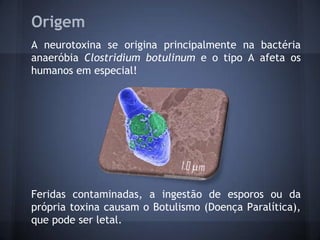
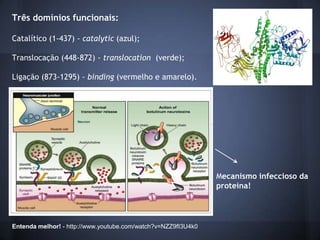
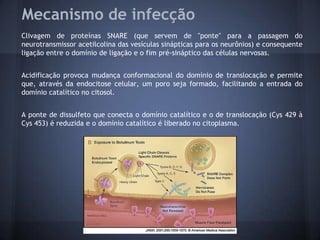
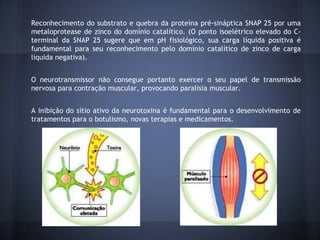
O documento descreve a estrutura e mecanismo de ação da neurotoxina botulínica tipo A, produzida pela bactéria Clostridium botulinum. A toxina causa a doença botulismo e é usada terapeuticamente para tratar distúrbios musculares. Ela é composta por três domínios proteicos que agem juntos para inibir a liberação do neurotransmissor acetilcolina e causar paralisia muscular.




![Referências Bibliográficas
[1] http://www.rcsb.org/pdb/explore/explore.do?structureId=3BTA
[2] http://www.cdc.gov/nczved/divisions/dfbmd/diseases/botulism/
[3] http://toxipedia.org/display/toxipedia/Botulinum+Toxin
[4] http://www.portalsaofrancisco.com.br/alfa/botulismo/botulismo-6.php
[5] http://www.wgate.com.br/conteudo/medicinaesaude/fisioterapia/variedades/botox.htm
[6] http://diariodonordeste.globo.com/materia.asp?codigo=629510
[7] http://www.ncbi.nlm.nih.gov/pubmed/23139852
[8] http://www.ncbi.nlm.nih.gov/pubmed/23068112
[9] http://www.ncbi.nlm.nih.gov/pubmed/9783750?dopt=Abstract
[10] http://www.ncbi.nlm.nih.gov/pubmed/22997495
[11] http://drauziovarella.com.br/doencas-e-sintomas/toxina-botulinica-2/
[12] http://egodonto.blogspot.com.br/2012/08/o-que-e-sialorreia.html](https://image.slidesharecdn.com/3btatbqa3ambrziopapai-121115073147-phpapp02/85/Botulinum-Neurotoxin-Tipo-A-10-320.jpg)