A Channelrhodopsin é uma proteína encontrada na alga verde Chlamydomonas reinhardtii que converte luz em sinais elétricos. Ela funciona como um canal iônico ativado por luz e tem sido usada em neurociência para mapear circuitos neurais e controlar a atividade de neurônios com precisão de milissegundos. Sua estrutura e mecanismo de ação permitem diversas aplicações em pesquisa e potencialmente no tratamento de doenças.
![Channelrhodopsin
[1] Juliana Baptista RA 11021711
Fábio RA](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/75/Channelrhodopsin-1-2048.jpg)

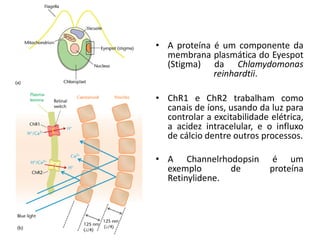
![A Proteína
• Encontram-se em dois modelos estruturais opsin-1 e opsin-2
(ChR1 e ChR2).
• É encontrada em uma espécie de alga verde unicelular:
Chlamydomonas reinhardtii (3005, NCBI*[10]).
Chlamydomonas reinhardtii](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/85/Channelrhodopsin-3-320.jpg)

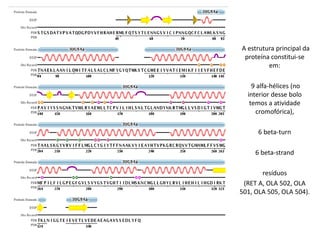
![Função biológica mais estrutura
O ChR2 absorve luz azul. Essa luz azul é absorvida no limite de um fóton para
cada trans-retinal. Quando toda sua parte trans- retinal absorve os fótons, isso induz
uma mudança conformacional de todos os 13 trans para cis-retinal. Assim a proteína
abre um poro de 6Å. Isso tudo em questão de milisegundos, voltando depois ao estado
original (trans), fechando o poro e parando o fluxo de íons - canal de íons (H+, Na+, K+, e
Ca2+). [2]](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/85/Channelrhodopsin-7-320.jpg)
![Aplicações
• O C-terminal da channelrhodopsin2 pode ser alterado (o resíduo C128 é
modificado), criando uma mutação da proteína tornando-a supersensível. Ela
acabe se abrindo após um impulso de luz azul e se fechando por meio de um
impulso de luz verde ou amarela.
Através desse dispositivo
aplicações como
fotoestimulação de neurônios
para sondar os circuitos neurais
são possíveis.
O ChR2 sensível ao azul e a
harlodopsin sensível ao
amarelo juntos permitem
múltiplas atividades de cores
óptica e silenciamento de
atividade neural com precisão
de milissegundos. [3]](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/85/Channelrhodopsin-8-320.jpg)
![• “A ChR2 marca por fluorescência axônios e sinapses estimulados por luz, os quais podem ser identificados
como tecido cerebral intacto. Isto é útil para estudar os eventos moleculares durante a indução de
plasticidade sináptica. ChR2 foi usada para mapear as conexões de longo alcance de um lado do cérebro
para o outro, e para mapear a localização espacial de entradas na árvore dendrítica de neurônios
individuais.” [4][5][6][7]
• “O comportamento dos animais transgênicos expressando ChR2 em subpopulações de neurônios pode ser
controlado remotamente por luz azul intenso. Isto tem sido demonstrado em nematóides, moscas de
fruta, peixe-zebra, e nos ratos. A função visual em ratos cegos pode ser parcialmente restaurada por
expressar ChR2 em células da retina interna. No futuro, ChR2 poderá encontrar aplicações médicas, por
exemplo, em formas de degeneração da retina ou para a estimulação cerebral profunda.” [8][9]
[11] ~200,00 pessoas têm implantes estimuladores elétricos
~600 pessoas estiveram seguramente sobre tratamento de terapia genética com o AAV. (O AAV, adeno-associated virus, é um vírus
que até então não causa doenças a humanos)
Testes pré-clínicos de Controle através da luz estão a caminho.](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/85/Channelrhodopsin-9-320.jpg)
![Referências Bibliográficas
Conteúdo texto
• [2] - Nagel G, Szellas T, Huhn W, et al. (November 25, 2003). "Channelrhodopsin-2, a directly light-gated cation-
selective membrane channel". Proc. Natl. Acad. Sci. U.S.A. 100 (24): 13940–
5.doi:10.1073/pnas.1936192100. PMC 283525.PMID 14615590.
• [3] - Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., and Deisseroth, K. (2005). "Millisecond-timescale,
genetically-targeted optical control of neural activity".Nature Neuroscience 8 (9): 1263–
1268.doi:10.1038/nn1525. PMID 16116447.
• [4] - Zhang YP, Oertner TG (February 2007). "Optical induction of synaptic plasticity using a light-sensitive
channel". Nat. Methods 4 (2): 139–41. Doi:10.1038/nmeth988. PMID 17195846.
• [5] - Zhang YP, Holbro N, Oertner TG (August 2008)."Optical induction of plasticity at single synapses reveals
input-specific accumulation of alphacamkii".Proc. Natl. Acad. Sci. U.S.A. 105 (33): 12039–
44.doi:10.1073/pnas.0802940105. PMC 2575337.PMID 18697934.
• [ 6] - Petreanu L, Huber D, Sobczyk A, Svoboda K (May 2007). "Channelrhodopsin-2-assisted circuit mapping of
long-range callosal projections". Nat. Neurosci. 10 (5): 663–8. Doi:10.1038/nn1891. PMID 17435752.
• [ 7] - Petreanu L, Mao T, Sternson SM, Svoboda K (February 2009). "The subcellular organization of neocortical
excitatory connections". Nature 457 (7233): 1142–5. Doi:10.1038/nature07709. PMC 2745650.PMID 19151697.
• [8] - Douglass AD, Kraves S, Deisseroth K, Schier AF, Engert F (August 2008). "Escape behavior elicited by single,
channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons". Curr. Biol. 18 (15): 1133–
7.doi:10.1016/j.cub.2008.06.077. PMC 2891506.PMID 18682213.
• [9] - Huber D, Petreanu L, Ghitani N, Ranade S, Hromádka T, Mainen Z, Svoboda K (January 2008)."Sparse optical
microstimulation in barrel cortex drives learned behaviour in freely moving mice". Nature 451(7174): 61–
4. Doi:10.1038/nature06445.PMC 3425380. PMID 18094685.
• Http://www.kurzweilai.net/using-light-to-create-a-more-reliable-pacemaker
• Http://www.metamicrobe.com/chlamy/ Chlamydomonas Center Http://www.els.net/wileycda/elsarticle
• Sakmar T (2002). "Structure of rhodopsin and the superfamily of seven-helical receptors: the same and not the
same". Curr Opin Cell Biol 14 (2): 189–95. Doi:10.1016/S0955-0674(02)00306-X.PMID 11891118.
• Nagel G, Szellas T, Kateriya S, Adeishvili N, Hegemann P, Bamberg E (2005). "Channelrhodopsins: directly light-
gated cation channels". Biochem Soc Trans 33 (Pt 4): 863–6.doi:10.1042/BST0330863. PMID 16042615.
• G Protein-Coupled Receptor Data Base
• Terakita A (2005). "The opsins". Genome Biol 6 (3): 213. Doi:10.1186/gb-2005-6-3-
213. PMC 1088937. PMID 15774036.](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/85/Channelrhodopsin-10-320.jpg)
![• RCSB PDB - http://www.rcsb.org/pdb/explore/explore.do?Structureid=3UG9
• PDBe - http://www.ebi.ac.uk/pdbe-srv/view/entry/3ug9/summary
• AmiGO - http://amigo.geneontology.org/cgi-bin/amigo/term_details?Term=GO:0016020
• [10] NCBI - http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?Mode=Info&id=3055
Imagem
• [1] Biological assembly 1 assigned by Kato, H.E., Ishitani, R., Nureki, O. And generated by PISA .
• Http://deepbluehome.blogspot.com.br/2010/10/life-stirs-oceans.html
(Chlamydomonas reinhardtii)
• [11] Retirada da palestra do Ed Boyden no TED.](https://image.slidesharecdn.com/channelrhodopsinv1-1-121115073506-phpapp01/85/Channelrhodopsin-11-320.jpg)