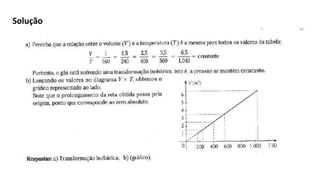
O documento discute as propriedades dos gases ideais e reais, incluindo:
1) A lei dos gases ideais relaciona proporcionalmente a pressão, volume e temperatura de um gás por meio da constante universal dos gases;
2) Gases reais desviam-se do comportamento ideal em altas densidades, devido às interações entre moléculas, requerendo a equação de Van der Waals.
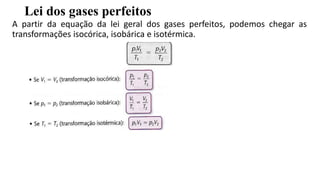
3) A equação de estado descreve transformações isocóricas, isobáricas e isotérmicas de gases ideais.