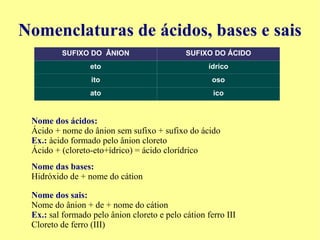
O documento apresenta um relatório de experimento sobre ácidos e bases realizado por alunos de ensino médio. O experimento testou diferentes substâncias como detergente, suco de laranja e limão usando extrato de beterraba como indicador de pH. Os resultados mostraram que o detergente, suco de laranja e limão tornaram o indicador vermelho, indicando que são ácidos, enquanto o bicarbonato de sódio tornou o indicador roxo escuro, indicando que é uma base.