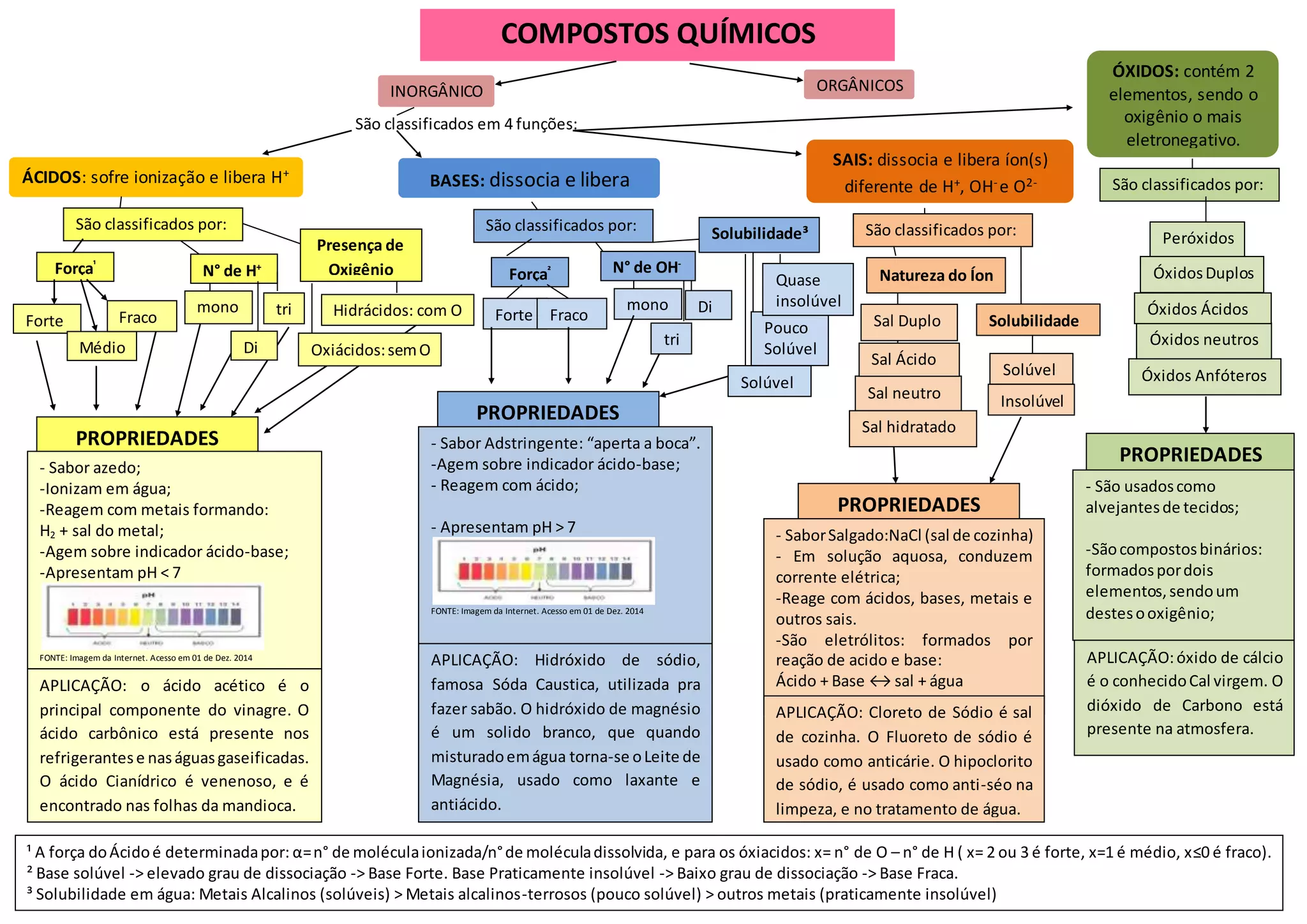
O documento classifica e descreve as propriedades de ácidos, bases, sais e óxidos. Ácidos liberam íons hidrogênio e são classificados por força e presença de oxigênio. Bases liberam íons hidróxido e são classificadas por força e solubilidade. Sais liberam íons que não são hidrogênio, hidróxido ou oxigênio e são classificados por natureza do íon e solubilidade. Óxidos contém oxigênio e outro elemento e são classificados por propriedades como neutros, á