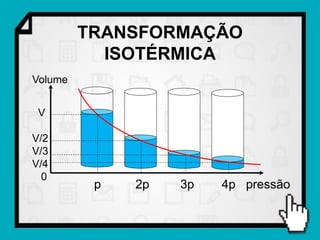
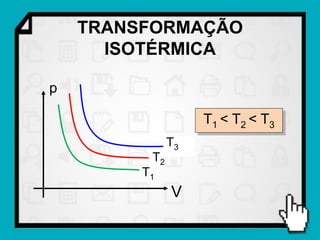
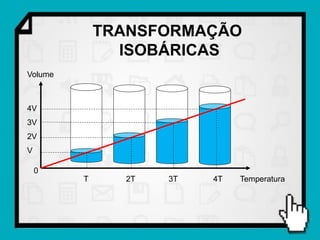
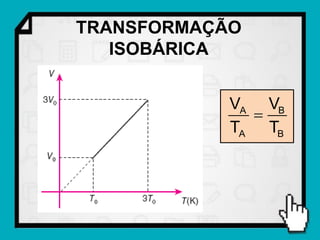
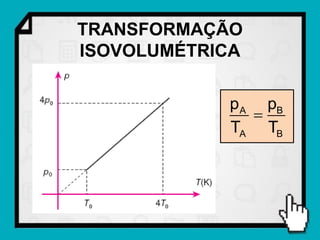
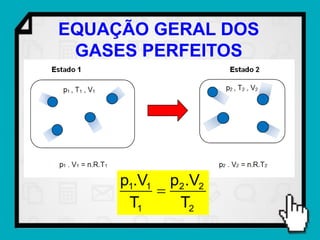
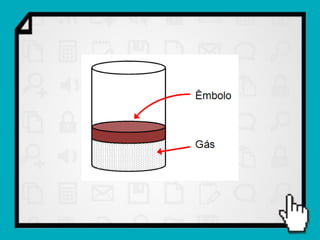
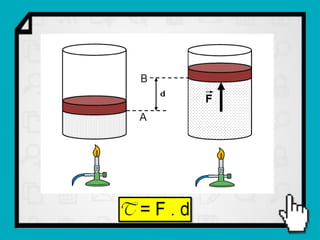
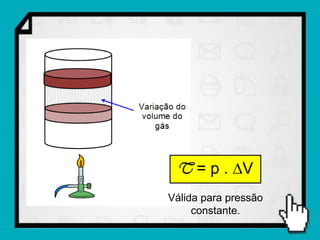
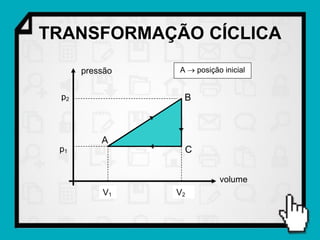
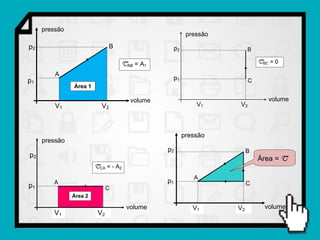
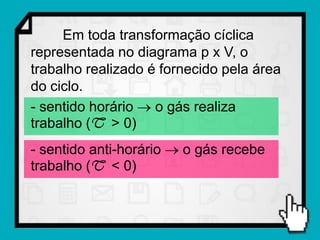
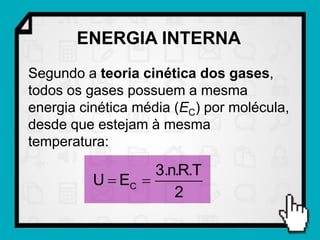
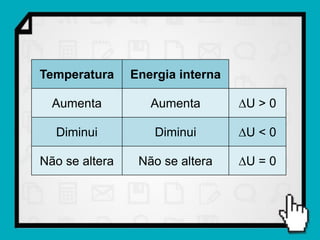
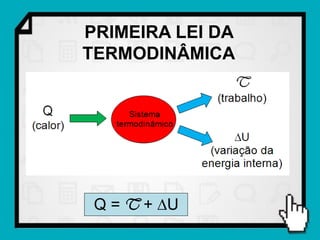
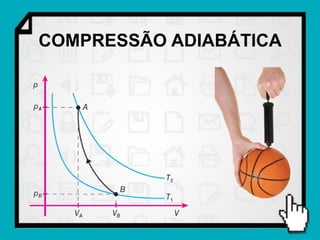
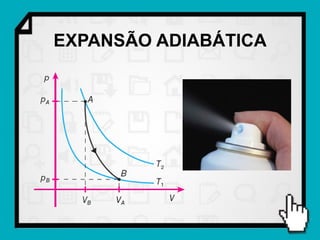
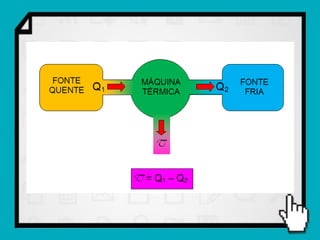
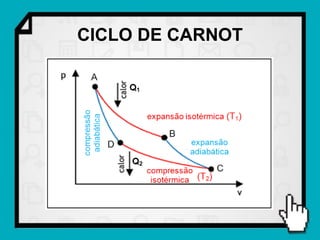
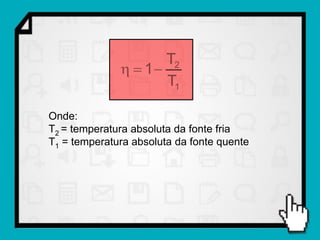
Este documento resume os principais conceitos da termodinâmica, incluindo: (1) as variáveis de estado de um gás, como pressão, volume e temperatura; (2) as leis dos gases ideais e transformações gasosas; e (3) a primeira e segunda lei da termodinâmica.