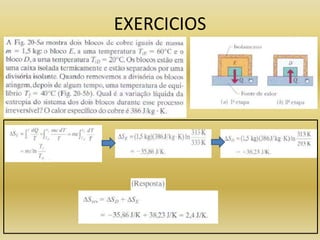
O documento discute o conceito de entropia na termodinâmica. A entropia está relacionada à segunda lei da termodinâmica e mede o grau de desordem de um sistema. Processos irreversíveis, como a mistura de açúcar em café, sempre aumentam a entropia de um sistema isolado de acordo com o postulado da entropia.