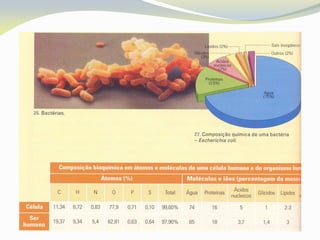
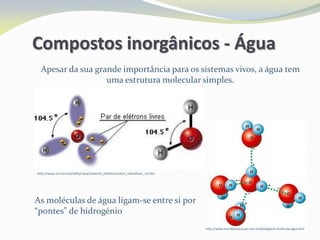
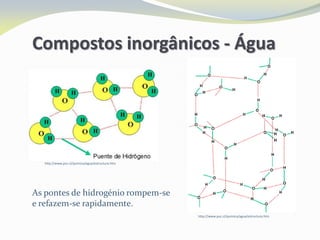
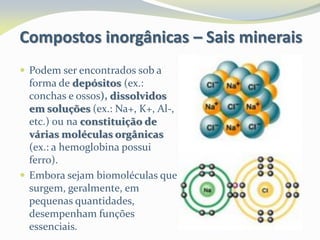
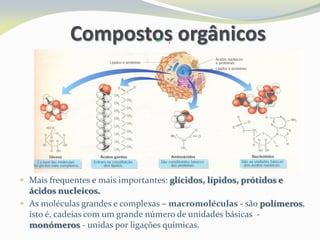
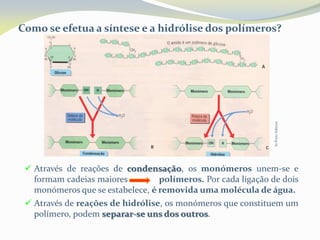
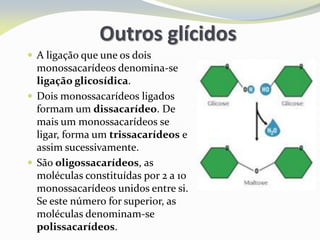
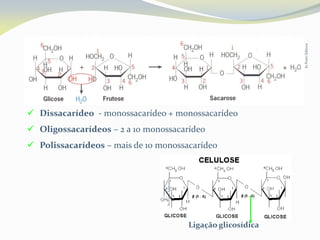
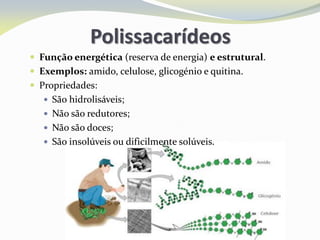
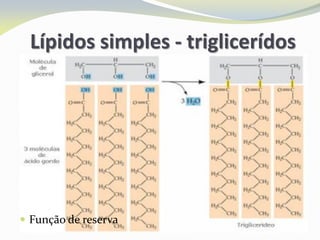
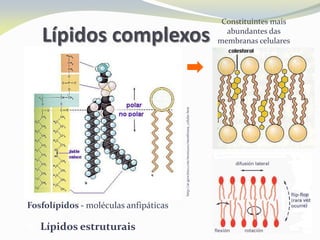
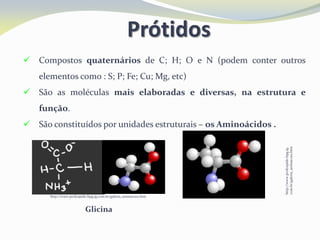
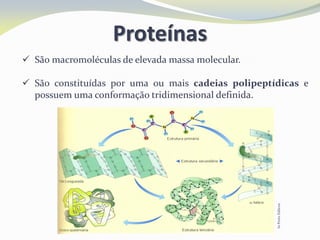
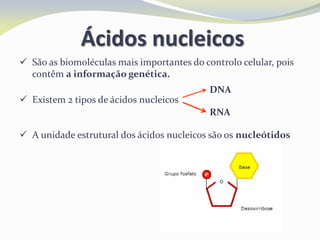
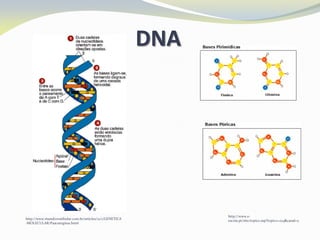
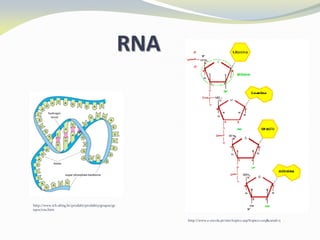
Este documento discute as biomoléculas que compõem os seres vivos, incluindo água, sais minerais, carboidratos, lípidos, proteínas e ácidos nucleicos. Explica que as biomoléculas são formadas pela combinação de bioelementos químicos e desempenham funções estruturais, energéticas e regulatórias nos organismos.