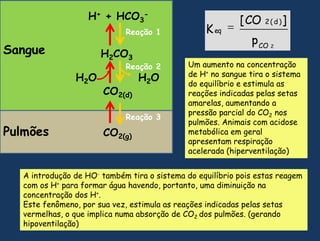
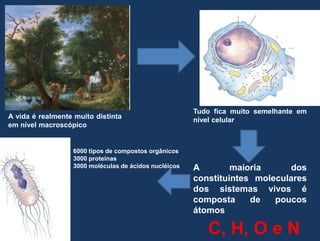
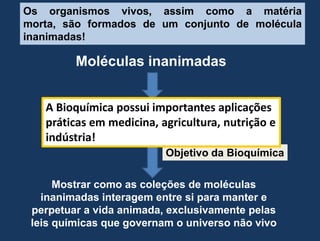
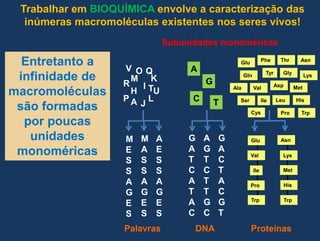
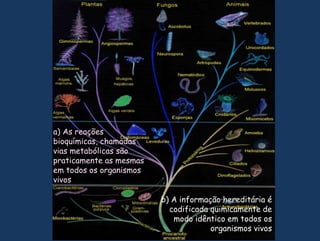
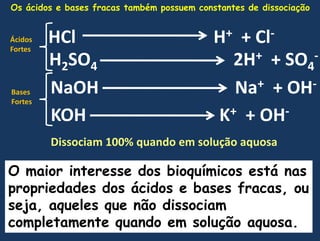
1) O documento discute os conceitos fundamentais de bioquímica, incluindo as características da vida, biomoléculas, e a importância da água para os sistemas vivos;
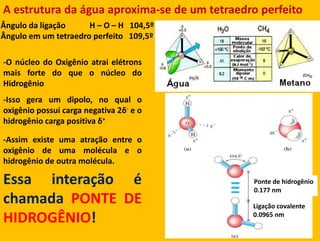
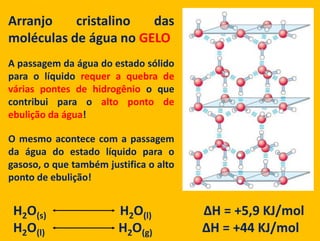
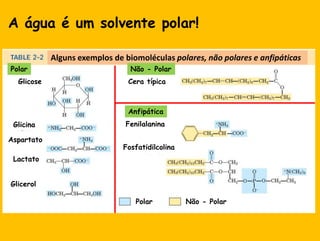
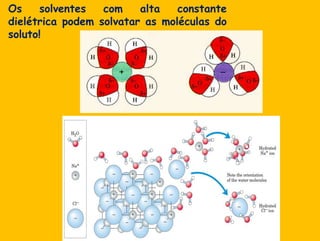
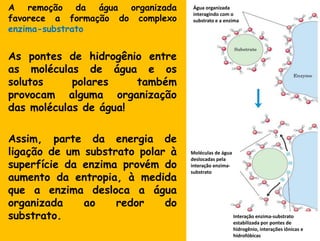
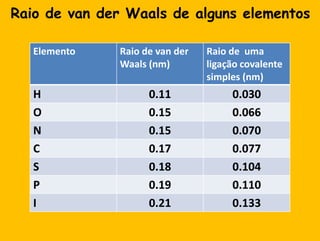
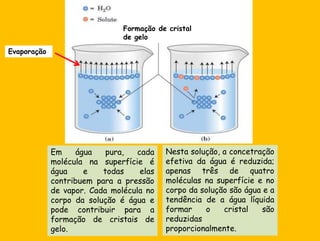
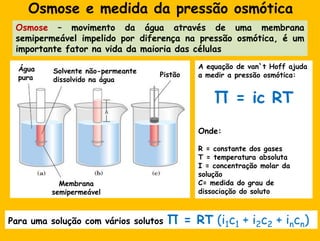
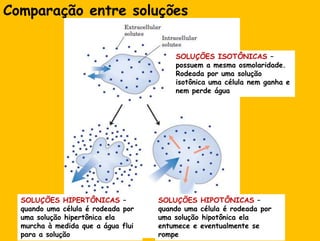
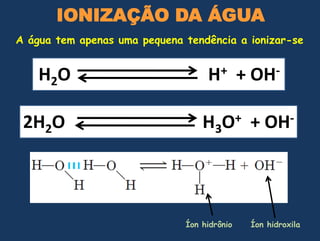
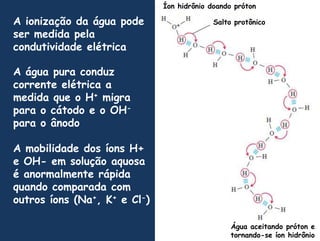
2) A água é essencial para a vida devido às suas propriedades únicas como solvente e sua habilidade de formar pontes de hidrogênio com biomoléculas;
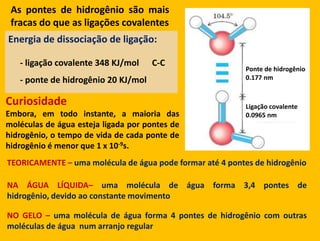
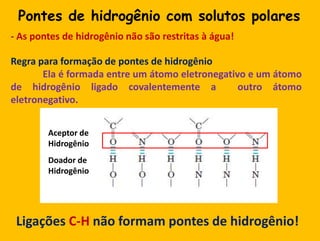
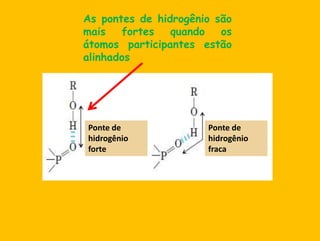
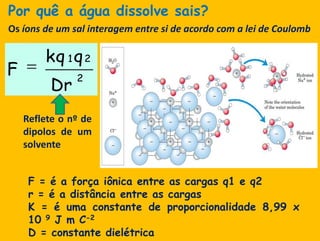
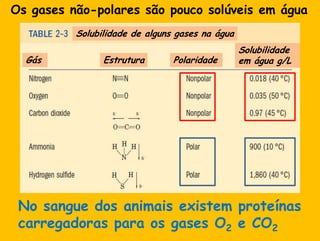
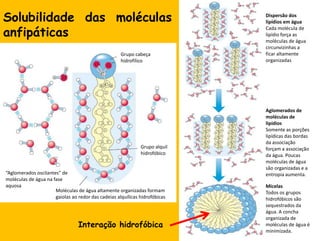
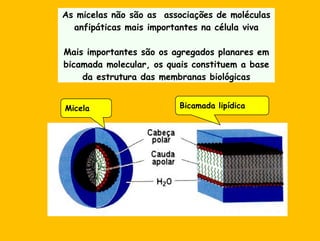
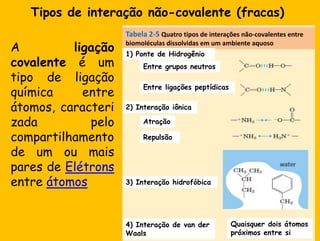
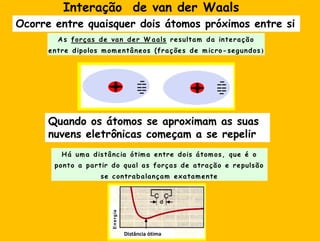
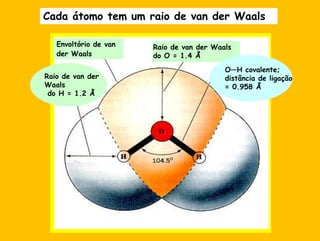
3) As interações não-covalentes como pontes de hidrogênio, interações iônicas e hidrofóbicas são cruciais para as funções biol








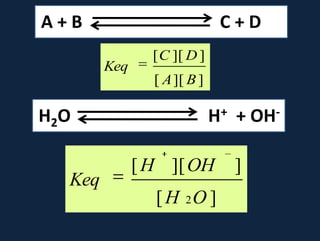
![O valor daKeq para a águapuramedidoporcondutividadeelétrica é 1,8 x 10-16MAssim:Kw = [H+] [OH-] = 55,5 x 1,8 x 10-16Kw = [H+] [OH-] = 1,0 x 10-14](https://image.slidesharecdn.com/gua-100326211523-phpapp02/85/aGua-39-320.jpg)
![Na águapura[H+] = [OH-] = 1,0 x 10-14[H+]2 = 1,0 x 10-14](https://image.slidesharecdn.com/gua-100326211523-phpapp02/85/aGua-40-320.jpg)
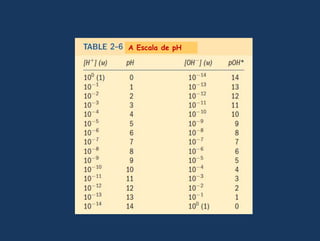
![A escala de pHpH é definidocomo o logarítmonegativodaconcentração de H+ no meioTomandologarítmonegativo do produtoiônicodaáguaChamando –log [H+] = pH e –log [OH-] = pOH](https://image.slidesharecdn.com/gua-100326211523-phpapp02/85/aGua-41-320.jpg)
![A escala de pH é prática e costuma ser usada entre 0 e 14Na água purapH = log[H+] = log(107)= 7Também na água pura:pOH = 14 – pH = 14 – 7 = 7AlvejantedomésticoAmoníacodomésticoAumentabasicidadeSolução de bicarbonato de sódioÁgua do marNeutroSanguehumanoImportante:Note que a escala de pH é logarítmica e nãoaritmética, ouseja, umasolução de pH 6,0 possui 10 vezesmaisprótons do queumasolução de pH 7,0.Leite, salivaCafé pretoCervejaSuco de tomateVinhotintoCoca-Cola, vinagreAumentaacidezSuco de limãoSucogástrico](https://image.slidesharecdn.com/gua-100326211523-phpapp02/85/aGua-42-320.jpg)


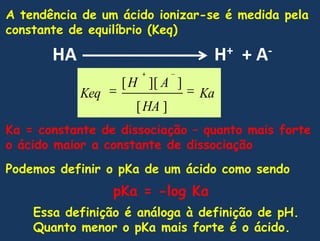
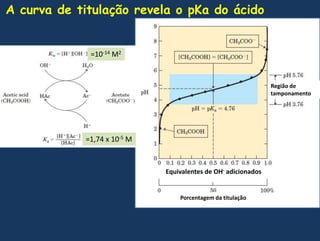
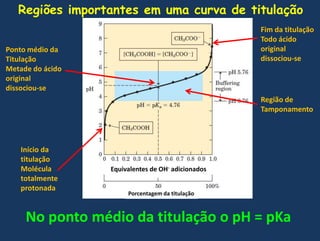
![Demonstrandomatematicamenteque no pontomédiodatitulação o pH = pKaQuandoemsoluçãoaquosaLogo a constante de dissociação é:Resolvendo para [H+]TomandologarítmosnegativosComo vimos-log[H+] = pH e –logKa = pKa, portanto](https://image.slidesharecdn.com/gua-100326211523-phpapp02/85/aGua-50-320.jpg)
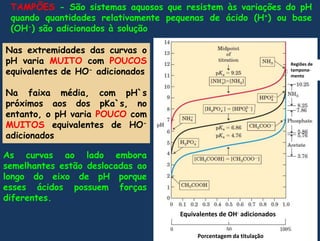
![Estaequação é conhecidacomoequação de Henderson-HasselbalchNo pontomédiodatitulação [A-] = [HA], logoLog 1 = 0, portantoImportante:O detalhemaisimportantenacurva de titulação de um ácidofraco é queelamostragraficamenteque um ácidofraco e o seuânion – um par ácido-base conjugado – podemfuncionarcomo um tampão](https://image.slidesharecdn.com/gua-100326211523-phpapp02/85/aGua-51-320.jpg)