Aminoácidos, peptídeos e proteínas
- 1. Aminoácidos, peptídeos e proteínas Profa. Dra. Marcia Mourão Ramos Azevedo
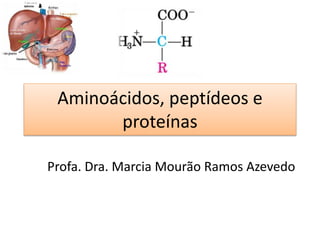
- 2. AMINOÁCIDOS • São unidades estruturais básicas dos peptídeos e das proteínas. • Todos os 20 aminoácidos comuns encontrados em proteínas são α-aminoácidos. Possuem um grupo carboxil e um grupo amino ligados ao mesmo átomo de carbono (o carbono α) Carbono α
- 3. AMINOÁCIDOS • Exceção prolina (um aminoácido cíclico) • Os aminoácidos diferem entre si na estrutura da cadeia lateral (grupo R), a qual varia em estrutura, tamanho e carga elétrica influencia a solubilidade dos aminoácidos em água. Estrutura geral de um aminoácido
- 4. AMINOÁCIDOS • Todos os aminoácidos comuns, exceto a glicina, possuem o carbono α ligado a quatro grupos diferentes: – Um grupo carboxil, – Um grupo amino – Um átomo de hidrogênio – Um grupo R • Um átomo de carbono ligado a quatro grupos diferentes é considerado assimétrico e chamado de centro quiral.
- 5. • Aminoácidos possuem 2 possíveis estereoisômeros (moléculas com as mesmas ligações químicas, mas com ≠ configurações), D ou L • Os aminoácidos presentes nas proteínas são estereoisômeros L • Glicina não tem isomeria óptica AMINOÁCIDOS
- 6. • Constituição de proteínas • Estrutura da célula • Hormônios • Receptores de proteínas e hormônios • Transporte de metabólitos e íons • Atividade enzimática • Imunidade • Gliconeogênese no jejum e diabetes FUNÇÕES BIOLÓGICAS DOS AAs
- 7. • Os aminoácidos podem ser classificados segundo dois princípios: –Classificação com base nas propriedades do grupo R, em particular, suas polaridade ou tendência em interagir com a água em pH biológico (próximo a 7). –Classificação segundo a essencialidade. CLASSIFICAÇÃO DOS AMINOÁCIDOS
- 9. Grupo R apolares e alifáticos • Interações hidrofóbicas • Gly Estrutura mais simples • Met Possui átomo de enxofre - tioéter • Pro Iminoácido, menor flexibilidade estrutural • Aminoácidos apolares e hidrofóbicos (insolúveis em água) • Ala, Val, Leu, Iso tendem a se aglomerar entre si nas proteínas
- 10. Grupo R aromáticos • São relativamente apolares hidrofóbicos • Tirosina pode formar ligações de hidrogênio • Fenilalanina – Mais apolar
- 11. Grupos R polares, não carregados • Solubilidade intermediária em água • Possuem grupos funcionais capaz de formar ligações de hidrogênio com a água • Serina e treonina – Grupos hidroxil • Asparagina e glutamina – Grupo amida • Cisteína – Grupo sulfidril – Ligações dissulfeto
- 12. Grupos R polares, não carregados • Asparagina e glutamina – Por hidrólise ácida ou básica geram aspartato e glutamato, respectivamente • Cisteína – É oxidada a cistina
- 13. Grupos R carregados Positivamente (básicos) • Aminoácidos hidrofílicos – Carga positiva – Lisina, segundo grupo amino – Arginina, grupo guanidina – Histidina, grupo aromático imidazol ( pode estar carregada positivamente como não carregada em pH 7,0 - Resíduos de His facilita diversas reações catalisadas por enzimas ao servirem como aceptores/doadores de prótons
- 14. Grupos R carregados negativamente (ácidos) • Aminoácidos ácidos – Carga negativa – Possuem segundo grupo ácido carboxílico
- 15. A Citocromo C oxidase é uma proteína integral da membrana interna de mitocôndrias A Lipase gástrica é uma proteína solúvel em meio aquoso. Proteínas são moléculas tridimensionais. A forma da molécula é determinante de sua função.
- 16. A Citocromo C oxidase é uma proteína de membrana. Proteínas de membrana possuem uma região de aminoácidos hidrofóbicos apolares, cujas cadeias laterais interagem com a porção lipídica de membrana celulares. Outras regiões dessas proteínas ricas em aminoácidos hidrofílicos polares projetam- se para os meios aquosos extra- ou intracelular, e podem formar “canais” hidrofílicos que atravessam a membrana, interconectando os meios separados por ela. Corte transversal da membrana interna da mitocôndria Aminoácidos apolares Aminoácidos polares
- 17. Classificação segundo a essencialidade Aminoácidos essenciais Aminoácidos não essenciais - Não podem ser sintetizados pelos animais ou os são, porém, em quantidades inferiores às necessidades do organismo – Valina – Leucina – Isoleucina – Metionina – Fenilalanina – Triptofano – Treonina – Lisina – Arginina – Histidina
- 18. Classificação segundo a essencialidade Aminoácidos não essenciais - Podem ser sintetizados pelos tecidos em quantidades que satisfazem as exigências do metabolismo, a partir de fontes de carbono e grupos amino – Glicina – Alanina – Prolina – Tirosina – Serina – Cisteína – Asparagina – Glutamina – Aspartato – Glutamato
- 19. aa essenciais
- 20. Aminoácidos incomuns • Modificações pós-traducionais São encontrados no colágeno, uma proteína fibrosa do tecidos conectivos Encontrada em proteínas de parede celular de plantas Constituinte da miosina proteina do músculo Encontrado na protrombina e proteínas que ligam Ca2+
- 21. Aminoácidos incomuns • Modificações pós-traducionais - Selênio é adicio- nado durante a síntese proteica - Derivada da serina - Derivado de 4 resíduos de lisina - Encontrado na proteína elastina
- 22. Aminoácidos incomuns Alguns resíduos de aminoácidos em uma proteína podem ser modificados para alterar a função da proteína
- 23. Aminoácidos incomuns Alguns resíduos de aminoácidos em uma proteína podem ser modificados para alterar a função da proteína
- 24. Aminoácidos incomuns • Intermediários-chave na biossíntese de arginina e no ciclo da ureia
- 25. Aminoácidos podem atuar como ácidos e bases • Grupo amino, carboxil e os grupos R ionizáveis de alguns aminoácidos funcionam como bases e ácidos fracos – Doam (ácidos) ou recebem (base) prótons • Zwitterion aa sem um grupo R ionizável é dissolvido em água a pH neutro ele passa a existir como um íon dipolar • Substâncias anfóteras possui natureza dual (ácido- base) Forma não iônica não ocorre em quantidades significativas em soluções aquosas
- 26. Aminoácidos podem atuar como ácidos e bases • Um α-aminoácido simples (monocarboxílico e monoamínico), quando totalmente protonado, é um ácido diprótico, possuindo dois grupos, (COOH e NH3 +), que podem fornecer prótons Carga Llquida: + 1 0 -1 Ponto isoelétrico (pI)
- 27. Titulação de um aminoácidos • Titulação ácido-base envolve a adição ou a remoção gradual de prótons. • Os 2 grupos ionizáveis da glicina o grupo carboxil e o grupo amino são titulados com uma base forte (NaOH) •Em pH muito baixo, a espécie iônica predominante da glicina é a forma completamente protonada • pKa: tendência de um grupo fornecer um próton. pKa fornecimento de prótons •Conclusão: a função das proteínas depende do pH ao qual estão submetidas Estágio I Desprotonação do grupo –COOH. pH = pKa (pK1) pI = 5,97 Remoção do 1º próton completa e a do 2º iniciada. Neste pH, a glicina apresenta- se como íon dipolar (zwitterion) Estágio II Remoção de um próton do grupo –NH3 +. pH = pKa = 9,60 A titulação está completa em um pH = 12 Forma predominante:
- 28. • Para a glicina que não possui grupo R ionizáveis, o ponto isoelétrico é a média aritmética dos dois valores de pKa • pI = (pK1 + pK2)/2 • pI = (2,34 + 9,60)/2 = 5,97 Titulação de um aminoácidos
- 29. • A glicina possui uma carga negativa líquida em qualquer pH acima de seu pI eletrodo positivo (ânodo) • Em pH abaixo de seu pI a glicina possui uma carga líquida positiva eletrodo negativo (cátodo) Titulação de um aminoácidos
- 30. Curvas de titulação predizem a carga elétrica dos aminoácidos • Alguns aminoácidos podem ter átomos ionizáveis também em sua cadeia lateral pI = 3,22 pI = 7,59
- 31. Peptídeo ligações peptídicas = grupo α-carboxil de um aminoácido e o grupo α-amino do outro
- 32. Peptídios de importância biológica Fonte: MARZZOCO, A., TORRES, B.B., 2007.
- 33. Classificação de Peptídeo • Os peptídeos são classificados de acordo com o número de unidades de aminoácidos. - Dipeptídeos, tripeptídeos, tetrapeptídeos... • Quando alguns poucos aminoácidos são unidos a estrutura resultante é chamada de oligopeptídeo. • Quando muitos aminoácidos são unidos, o produto é chamado de polipeptídeo.
- 34. A ligação Peptídica é rígida e planar A ligação peptídica (C-N) é mais curta que a ligação (C-N) de uma amina simples Átomos associados à ligação são planares Compartilhamento parcial de 2 pares de elétrons entre o oxigênio carbonílico e o nitrogênio da amida. Formação de um DIPOLO ELÉTRICO. -Os 6 átomos do grupo peptídico estão em um único plano. - Átomo de O trans ao átomo de H - As ligações peptídicas C-N não podem girar livremente caráter parcial de ligação dupla. O C de resíduos adjacentes de aminoácidos são separados por 3 ligações covalentes Cα—C―N—Cα
- 35. A cadeia polipeptídica possui uma série de planos rígidos ϕ C―N—Cα—C (rotação entre N—Cα) ψ N—Cα―C—N (rotação entre C―C) Φ e ψ = ± 1800 ω Cα—C―N—Cα (C―N, lig peptídica rotação restrita) C C CC C C R R RO O O N N N H H H HH Os planos rígidos compartilham um ponto comum de rotação no C ω A ligação peptídica é rígida e plana. Isto ocorre devido a um caráter parcial de dupla ligação entre o carbono da carbonila e o nitrogênio da amina. Isso impede que ocorra rotação neste eixo. Por outro lado, ocorrem rotações nas ligações entre N-C (rotação ) e entre C-C da carbonila (rotação )
- 36. Dados moleculares de algumas proteína
- 37. Níveis estruturais das proteínas A estrutura primária consiste em uma sequência de aminoácidos unidos por ligações peptídicas e inclui algumas ligações dissulfeto. A estrutura secundária é o arranjo espacial dos átomos da cadeia principal em um determinado segmento da cadeia polipeptídica. Hélices α, folha β e voltas β A estrutura terciária é o arranjo tridimensional total de todos os átomos de uma proteína. Aminoácidos distantes e em diferentes estruturas secundárias podem interagir. A estrutura quaternária é o arranjo tridimensional de duas ou mais cadeias polipeptídicas, ou subunidades.
- 38. . ESTRUTURA PRIMÁRIA • É o nível estrutural mais simples e mais importante, pois dele deriva todo o arranjo espacial da molécula. • É a seqüência de aminoácidos na cadeia polipeptídica; mantida por ligações peptídicas . • As pontes dissulfeto (S-S) também devem ser assinaladas na estrutura primária de uma proteína. Estrutura primária Consiste em uma sequência de aminoácidos unidos por ligações peptídicas e inclui algumas ligações dissulfeto.
- 39. É o arranjo espacial dos átomos da cadeia principal em um determinado segmento da cadeia polipeptídica • Ligações de hidrogênio ocorrem entre o hidrogênio do grupo –NH e o oxigênio do grupo C ═ O •Estrutura secundária comum ocorre quando cada ângulo diedro, ϕ e ψ, permanece + ou - igual, ao longo do segmento ESTRUTURA SECUNDÁRIA • Hélices α; conformações β e volta β
- 40. Hélice α ESTRUTURA SECUNDÁRIA Alanina melhor tendência em forma hélice-α Pro e Gly menor propensão em formar hélice α ϕ = -570 e ψ = -470 Cada volta da hélice = 3,6 resíduos de aa
- 41. ESTRUTURA SECUNDÁRIA Tendência dos aminoácidos em assumir a conformação de Hélice α
- 42. O esqueleto da cadeia polipeptídica está estendido em forma de zigue-zague, ao invés de uma estrutura helicoidal ESTRUTURA SECUNDÁRIA Conformações β ϕ = -1390 e ψ = +1350 ϕ = -1190 e ψ = +1130 Fazem pontes de H entre os átomos da ligação peptídica
- 43. São elemento conectores que liga estruturas sucessivas de hélices α e conformações β ESTRUTURA SECUNDÁRIA Voltas β Os resíduos Gly e Pro frequentemente ocorrem em voltas β Conectam as extremidades de dois segmentos adjacentes de uma folha β antiparalela
- 45. . ESTRUTURA TERCIÁRIA É o arranjo tridimensional total de todos os átomos da cadeia poliptídica Aminoácidos distantes na sequência polipeptídica e em diferentes tipos de estruturas secundárias podem interagir na estrutura proteica dobrada Enovelamento de uma cadeia polipeptídica como um todo Ocorrem ligações entre os átomos dos radicais R de todos os aminoácidos da molécula
- 46. . ESTRUTURA TERCIÁRIA Subunidade (uma cadeia polipeptídica)
- 47. . Associação de duas ou mais cadeias polipeptídicas ESTRUTURA QUATERNÁRIA Proteína (Duas subunidades )
- 48. FORÇAS NÃO COVALENTES Pontes de H -Aminoácidos polares Ligações iônicas - Aminoácidos carregados Interações hidrofóbicas -Aminoácidos apolares Forças de Van der Waals -Qualquer aminoácido ProteínaProteína NH — CH2 — OH ... O — C — CH2 — CH2 — 2 ProteínaProteína O —CH Ponte de Hidrogênio Interações hidrofóbicas e Forças de van der Waals 2 CH —CH3 CH3 CH3 CH3 — CH — CH2 — — CH — CH3 H3C — CH — CH3 CH3 ++—CH2—CH2—NH3 O C —CH2—CH2—Ligação Iônica Quais são os tipos de forças que mantém a estrutura tridimensional de uma proteína ? Quais são os tipos de forças que mantém a estrutura tridimensional de uma proteína ?
- 49. O hormônio insulina é composto por duas subunidades, A e B, unidas por duas pontes dissulfeto intercadeia. Além disso, a cadeia B possui uma ponte dissulfeto intracadeia A B Quais são os tipos de forças que mantém a estrutura tridimensional de uma proteína ? Além dos laços não covelentes, uma proteína pode ter pontes dissulfeto formada a partir de dois resíduos do aminoácido Cys (cisteína). Pontes dissulfeto são covalentes e só podem ser rompidas por agentes redutores, como 2-mercapto-etanol.
- 50. Classificação das proteínas QUANTO A SUA COMPOSIÇÃO Proteínas simples: Por hidrólise liberam apenas aminoácidos. Ex. albumina, globulina, actina, miosina. Proteínas conjugadas: contém componentes químicos associados denominado grupo prostético. - lipoproteínas contêm lipídeos (lipoproteína sanguínea) - glicoproteínas contêm carboidratos (Imunoglobulinas) - metaloproteína contêm um metal específico (ferro – ferritina)
- 51. Classificação das proteínas QUANTO AO NÚMERO DE CADEIAS POLIPEPTÍDICAS Proteínas com uma única cadeia polipeptídica - Mioglobina (153 resíduos) - Citocromo C (104 “) - Titina (humano) (27.000 “) Proteínas Multissubunidade - Formadas por mais de uma cadeia polipeptídica. Ex. Hexocinase (2). Quando apresenta ao menos duas subunidades idênticas Oligomérica. Ex. Hemoglobina (4) E as subunidades idênticas denominadas de Protômero.
- 52. Classificação das proteínas QUANTO A SUA FORMA Proteínas fibrosas - são adaptadas às funções estruturais. Apresentam cadeias polipeptídicas arranjadas em longos filamentos. Em geral são formadas por um único tipo de estrutura secundária (hélices-α ou conformações β). São insolúveis em água. Garantem aos vertebrados suporte, forma e proteção externa. - α-queratina (hélices-α ligadas por ligações dissulfeto) - Fibroínas da seda (conformações β) - Colágeno (hélice tripla de colágeno)
- 53. Classificação das proteínas QUANTO A SUA FORMA Proteínas globulares- apresentam cadeias polipeptídicas dobradas em uma forma esférica ou globular, geralmente contêm diversos tipos de estruturas secundárias na mesma cadeia de polipeptídeo. São geralmente solúveis. Exemplo: enzimas, Hemoglobina, mioglobina, imunoglobulinas
- 55. Perda de estrutura tridimensional originada pela ruptura de algumas ligações suficiente para causar a perda de função Causas: pelo calor, pHs extremos, solventes orgânicos miscíveis (álcool ou acetona), certos solutos (ureia e hidrocloreto de guanidina), ou detergentes. Na desnaturação ocorre o desdobramento da proteína mantendo-se intacta a sua estrutura primária. Desnaturação protéica
- 56. Se retornarem às condições ideais de temperatura, pressão e pH as moléculas desnaturadas reassumem suas estruturas nativas e suas atividades biológicas Renaturação protéica
- 58. 1. Quais as principais diferenças entre a hélice α e a conformação β? 2. Descreva os processos de desnaturação e renaturação proteica. 3. A estrutura terciária das proteínas é mantida por um conjunto de forças. Cite e descreva cada uma delas. 4. Defina proteínas e diga quais são os produtos de hidrólise total de uma proteína. 5. Escreva a fórmula geral de um aminoácido, citando os componentes dessa fórmula.
- 59. 6. Como se chama a ligação entre dois aminoácidos? Como se forma essa ligação? 7. Diferencie e exemplifique proteínas fibrosas e globulares. 8. Dê a classificação dos aminoácidos com base nas propriedades do grupo R. 9. Liste algumas funções dos aminoácidos. 10. Responda as questões abaixo. a) Qual é o aminoácido mais simples presente na natureza? b) Qual é o aminoácido que é exceção à formula estrutural geral dos aminoácidos?
