Partículas subatômicas e evolução dos modelos atômicos
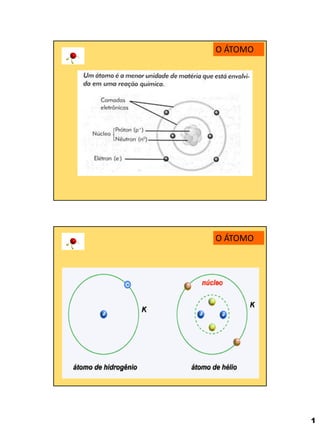
- 1. 1 O ÁTOMO O ÁTOMO
- 2. 2 O ÁTOMO Nome Símbolo Localiza- ção Carga relativa u Carga efetiva C Massa relativa u Massa efetiva g Protão P Núcleo +1 + 1,6.10-19 1 ~1,67.10-24 Neutrão N Núcleo 0 0 1 ~1,67.10-24 Eletrão e- Eletrosfera Ou Nuvem eletrónica -1 -1,6.10-19 1/1836 ~9,11.10-28 PARTÍCULAS SUBATÓMICAS
- 3. 3 NÚMERO ATÓMICO (Z) É a identificação de um átomo. Corresponde ao número de protões presentes no núcleo. Z=P Cada elemento químico tem um número atómico característico NÚMERO ATÓMICO (Z) Z=P O átomo é eletricamente neutro, ou seja, o n.º de protões é igual ao n.º de eletrões. Todos os átomos do mesmo elemento têm o mesmo número atómico.
- 4. 4 Símbolo do elemento químico número atómico NÚMERO ATÓMICO (Z) NÚMERO DE MASSA (A) É o somatório de protões e neutrões. A=P+N Ex: P=11 Sódio (Na) N=12 Z= A= e-=11 Alumínio (Aℓ) Z = 13 11 23 A = 27 P=13 e-=13 N=14 Z = 13
- 5. 5 número de massa número atómico
- 6. 6 São átomos do mesmo elemento químico (com o mesmo número atómico) e com diferente número de massa. ISO = mesmo TOPOS = lugar ISÓTOPOS ISÓTOPOS Ex:Isótopos do Hidrogénio 1H1 Hidrogénio ou Hidrogénio leve ou prótio 1H2 Hidrogénio pesado ou deutério 1H3 Trítio
- 7. 7 6 protões 6 neutrões 6 eletrões 6 protões 7 neutrões 6 eletrões 6 protões 8 neutrões 6 eletrões Carbono - 12 Carbono - 13 Carbono - 14 ISÓTOPOS Será possível determinar a massa de um só átomo com uma balança? Porquê? A massa de um átomo depende do seu numero de protões, neutrões e eletrões. Como os átomos são muito pequenos (um grão de pó contém cerca de 1016 átomos!), não é possível pesar um só átomo por mais sensível e rigorosa que seja a balança. MASSA ATÓMICA RELATIVA (Ar)
- 8. 8 A massa - padrão usada atualmente é 1/12 da massa do átomo de carbono-12. MASSA ATÓMICA RELATIVA (Ar) MASSA ATÓMICA RELATIVA (Ar) A massa atómica relativa de um elemento químico X, Ar(X), indica o número de vezes que a massa média dos átomos desse elemento (tendo em conta as abundâncias dos seus isótopos naturais) é superior à massa do padrão escolhido.
- 9. 9 Consideremos como exemplo o elemento cloro. Este elemento tem dois isótopos: Cerca de 75% é do isótopo 35Cl Cerca de 25 % é do isótopo 37Cl Assim, a massa atómica relativa do cloro, Ar(Cl), será Ar = (75 x 35) + (25 x 37) 100 = 35,50 MASSA ATÓMICA RELATIVA (Ar) MASSA ATÓMICA RELATIVA (Ar) Exercício Com base nas informações da tabela abaixo determine a massa atómica relativa do Lítio, Ar(Li). Massa relativa do isótopo
- 10. 10 IÕES São átomos ou grupo de átomos com excesso de carga. P ≠ e- CATIÕES (+): perdem eletrões P > e- ANIÕES (-): ganham eletrões P < e- IÕES
- 11. 11 IÕES Átomo e Modelos Atómicos
- 12. 12 Demócrito (Sec. V a.C.) Átomo Demócrito (460 – 370 A.C.) defendeu a ideia de que a matéria era composta por pequeníssimas partículas indivisíveis. Modelo baseado apenas na intuição e na lógica. Modelo proposto por Demócrito: Toda a matéria é constituída por átomos e vazio; O átomo é uma partícula pequeníssima, invisível,e que não pode ser dividida; Os átomos encontram-se em constante movimento; Universo constituído por um número infinito de átomos, indivisíveis e eternos;
- 13. 13 Dalton (1807) Séc. XIX – Dalton “ressuscita” A Teoria Atómica. John Dalton (1776 – 1844) Na segunda metade do séc. XVIII, a Química sofreu uma grande evolução. Certos factos não podiam ser explicados pela teoria de Aristóteles, como a Lei de Lavoisier: “A massa dos reagentes é igual à massa dos produtos”. Para explicar estes factos Jonh Dalton propôs, em 1807, o seu modelo atómico. Átomo Modelo proposto por Dalton: A matéria é composta por pequenos corpúsculos, que não se subdividem – os Átomos; Os átomos do mesmo elemento são iguais entre si – têm a mesma massa; A matéria é formada pela união de diferentes átomos em proporções definidas.
- 14. 14 Thomson (1904) J. J. Thomson (1856 - 1940) Thomson realizou uma série de experiências utilizando um tubo de raios catódicos (tubo semelhante aos tubos existentes no interior dos televisores). Neste tubo, eram efectuadas descargas eléctricas através de um gás rarefeito. Tubo de raios catódicos
- 15. 15 Em 1897 Thomson propõe um novo modelo: Ao estudar as descargas no interior deste aparelho, Thomson, descobriu o electrão. A descarga emitida tinha carga eléctrica negativa e era de natureza corpuscular. A sua massa era muito menor que a massa de qualquer átomo conhecido – eram os electrões. Thomson provou que os electrões eram corpúsculos, dotados de carga eléctrica e de massa, que fazem parte de toda a matéria. Observava-se uma fluorescência esverdeada devido à existência de partículas de carga negativa que saem dos átomos do cátodo. Eletrões (partículas com carga elétrica negativa) Esfera com carga eléctrica positiva Modelo proposto por Thomson (1904): O átomo era uma esfera maciça de carga elétrica positiva, estando os eletrões dispersos na esfera. O número de eletrões seria tal que a carga total do átomo seria zero. Modelo do “Pudim de Passas”
- 16. 16 Rutherford (1911) Ernest Rutherford (1871 - 1937) Cientista neozelandês, estudou com J.J. Thomson. Em 1908 realizou uma experiência que lhe permitiu propor um novo modelo atómico. Experiência de Rutherford Fonte de partículas Feixe de partículas Ecrã fluorescente Folha de ouro
- 17. 17 Embora a maior parte das partículas se comportasse como esperado, uma parte significativa não só foi desviada, como algumas voltaram para trás. Resultados da experiência de Rutherford Partículas α Existe, no interior do átomo, uma região central positiva – o núcleo, que exerce fortes forças repulsivas sobre as partículas alfa. Modelo proposto por Rutherford (1911): •O átomo é uma estrutura praticamente vazia, É constituído por: • Núcleo muito pequeno com a carga positiva, onde se concentra quase toda a massa do átomo. • Eletrões com carga negativa movendo-se em volta do núcleo. O átomo seria um sistema semelhante ao sistema solar. Modelo Planetário
- 18. 18 Mas este modelo era incompatível com algumas das teorias da Física ... De acordo com o que se conhecia, o electrão ao realizar a sua órbita perderia energia acabando por cair sobre o núcleo, destruindo o átomo. Bohr (1913) Niels Bohr (1885 - 1962) Niels Bohr trabalhou com Thomson, e posteriormente com Rutherford. Tendo continuado o trabalho destes dois físicos, aperfeiçoou, em 1913, o modelo atómico de Rutherford.
- 19. 19 Modelo proposto por Bohr : Apenas algumas órbitas seriam permitidas aos eletrões; Cada órbita correspondia a um nível de energia bem definido do eletrão; Os eletrões podem saltar de uma órbita para outra, ao absorver ou emitir energia. O nível mais energético seria o mais distante do núcleo, e o menos energético o mais próximo. Também este modelo apresentava algumas falhas... Este modelo adequa-se muito bem a átomos com apenas um electrão, falhando para átomos com vários electrões; Este modelo também não explica a interacção entre vários átomos. No entanto, ainda é o modelo mental utilizado por muitos cientistas, visto ser de fácil visualização.
- 20. 20 Por volta de 1927, os cientistas deixaram de acreditar que o electrão teria uma trajectória bem definida em torno do núcleo. Schrödinger (1927) Erwin Schrödinger (1887 – 1961) Nuvem electrónica Schrödinger propôs o modelo da Nuvem electrónica...
- 21. 21 Os eletrões movem-se de forma desconhecida com velocidade elevadíssima; O movimento do eletrão passou a ser descrito por uma nuvem eletrónica; Quanto mais densa é a nuvem, maior é a probabilidade de se encontrar aí o eletrão; A nuvem é mais densa próximo do núcleo, e menos densa longe do núcleo. Modelo da Nuvem Eletrónica (Schrödinger) Mas de que é feito o núcleo atómico? Até 1920, o núcleo do átomo era considerado com uma esfera maciça de carga eléctrica positiva. + + + + + + + + + + Mas, em 1920, Rutherford caracteriza o protão como sendo a unidade de carga eléctrica positiva. No decurso das suas investigações depara-se com: Átomos do mesmo elemento químico apresentam massas diferentes. Deverá existir outra partícula no núcleo atómico!
- 22. 22 Chadwick: 1932 Mas só em 1932, James Chadwick descobre o neutrão. Após vários anos de busca, encontrou, em 1932, uma partícula subatómica no núcleo do átomo, além do já conhecido protão. James Chadwick (1891 – 1974) O Neutrão não tem carga eléctrica, e tem aproximadamente a mesma massa do protão. + + + Modelo de Demócrito Modelo de Thomson Modelo de Bohr Modelo de Dalton Modelo de Rutherford Modelo da Nuvem Electrónica Evolução do Modelo atómico…
- 23. 23 “Fotografar” os átomos... Hoje em dia dispomos de potentes microscópios que nos permitem obter imagens dos átomos: são os microscópios electrónicos. Dimensão dos átomos 100 pm 1 pm = 10-12 m 1 Å = 10-10 m 1 nm = 10-9 m 1 Å = 100 pm 1 Å = 0,1 nm
- 24. 24 Dimensão dos átomos Se 100 milhões de pessoas se reduzissem ao tamanho de átomos, formavam uma fila de apenas 1cm. Um ponto final pode conter mais de 3 milhões de átomos. Notação de Lewis É constituída pelo símbolo de um elemento rodeado por um ponto por cada eletrão de valência presente no átomo desse elemento. H H
- 25. 25 Molécula de hidrogénio H2 H H H H 1 1 H 1s Molécula de oxigénio O2 ou 8O – 2:6 Última camada
