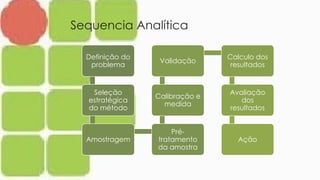
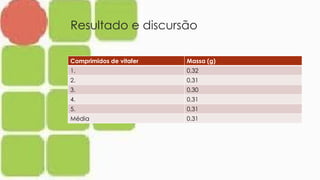
O documento aborda a volumetria de oxi-redução para determinar o teor de ferro, destacando a importância do ferro na indústria e sua presença em diversos alimentos. Também discute a anemia ferropriva como um problema de saúde global e os efeitos do déficit e excesso de ferro no organismo. Além disso, apresenta a técnica de permanganometria e resultados experimentais da análise de sulfato ferroso em comprimidos.