1) No século 18, químicos como Lavoisier e Proust estabeleceram leis fundamentais sobre reações químicas através de experimentos cuidadosos.
2) Lavoisier formulou a Lei da Conservação das Massas, que afirma que a massa total de reagentes é igual à massa total de produtos em uma reação química.
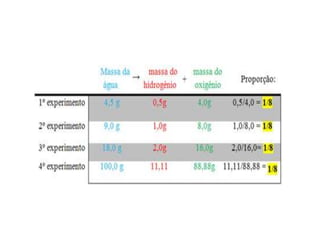
3) Proust formulou a Lei das Proporções Constantes, que afirma que as proporções de massa dos reagentes e produtos em uma reação química são sempre as mesm